
【题目】下列气体既能用排水法又能用向下排空气法收集的是( )
A. H2B. O2C. NH3D. NO
科目:高中化学 来源: 题型:
【题目】过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
![]()
下列有关说法正确的是
A. ①煮沸的主要目的是为了除去溶解的CO2
B. ②的反应中H2O2作氧化剂,氨水用来调节溶液的pH
C. ②中结晶的颗粒较小,过滤时可用玻璃棒轻轻搅动
D. ③醇洗的主要目的是为了减少晶体的损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、稀盐酸、澄清石灰水、氯化铜溶液是中学化学中常见物质,四种物质间的反应关系如图所示。图中两圆相交部分(A、B、C、D)表示物质间的反应,其中对应的离子方程式书写正确的是

A. OH+HCl=H2O+ClB. Ca(OH)2+Cu2+=Ca2++Cu(OH)2
C. Fe+Cu2+=Cu+Fe2+D. Fe+2H+=Fe3++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1).某溶液有Cl-、CO![]() 、SO
、SO![]() ,要求依次检验出这三种离子,请完成下列实验设计:
,要求依次检验出这三种离子,请完成下列实验设计:
检验离子 | 所加试剂 | 实验现象 | 离子方程式 |
①CO | 稀硝酸 | _________ | _________ |
②SO | _________ | 产生白色沉淀 | _________ |
③ Cl- | _________ | 产生白色沉淀 | _________ |
(2)KCl样品中含有少量K2CO3、K2SO4和不溶于水的杂质,为了提纯KCl,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作:
回答下列问题:

①试剂Ⅰ的化学式为________________,判断试剂Ⅰ已加过量的方法是_____________。
② ②中加入试剂Ⅱ的目的是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类比pH的定义,对于稀溶液可以定义pC=-lgC,pKa=-lgKa,常温下,某浓度H2A溶液在不同pH值下,测得pC(H2A)、pC(HA-)、pC(A2-)变化如图所示,下列说法正确的是
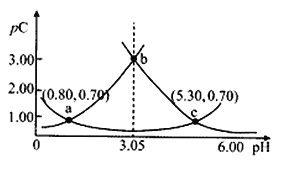
A. 随着pH的增大,pC增大的曲线是A2-的物质的量浓度的负对数
B. pH=3. 50 时, c(HA-)>c(A2-)>c(H2A)
C. b点时c(H2A).c(A2-)/c2(HA-)=104.5
D. pH=3.00~5.30时,c(H2A)+c(HA-)+c(A2-)先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油是一种重要的能源,通过石油分馏可得到重油,以重油为原料,可合成X:CH3COOCH=CH2。其中A是最简单的烯烃,B能发生银镜反应,D的相对分子质量比A小2。请回答下列有关问题:

(1)A中的官能团名称是___________________
(2)B→C的化学方程式_____________________________
(3)已知C与D发生加成反应生成X,其化学方程式为________________________
(4)下列说法正确的是_____
A.此处的“某工艺”指的是分馏 B.B在一定条件下能与氢气发生加成反应
C.X不溶于水,能使酸性高锰酸钾溶液褪色 D.可用溴的四氯化碳溶液鉴别A和D
(5)F是X的同分异构体,1molF能与4molAg(NH3)2OH反应,写出F可能的结构简式_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:除去CO的化学反应方程式为:[Cu(NH3)]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3。
请回答下列问题
(1)基态Fe原子的核外电子排布式为______________________;
(2)铁的一种配合物Fe(CO)x的中心原子价电子数与配体用于成键提供的电子数之和为18,则x=__________;已知该配合物的熔点为-20.5℃,沸点为103℃,易溶于CC14,据此可以判断Fe(CO)x晶体属于___________(填晶体类型)。与CO互为等电子体的分子的分子式为___________。
(3)配合物[Cu(NH3)]OOCCH3中碳原子的杂化类型是___________。用[Cu(NH3)]OOCCH3除去CO的反应中,肯定有___________形成。
a.离子键 b.配位键 c.非极性键 d.σ键
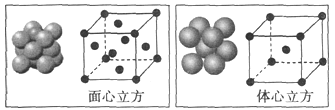
(4)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为___________。铁晶体的体心立方堆积空间利用率为___________(用含π的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下列实验装置及药品能实现相应实验目的的是

A. 甲用于制取NaHCO3晶体 B. 乙用于分离I2和NH4Cl
C. 丙用于证明非金属性强弱:Cl>C>Si D. 丁用于测定某稀醋酸的物质的量浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应:CH3OH(g)+CO(g) ![]() CH3COOH(g)ΔH<0。下列说法正确的是
CH3COOH(g)ΔH<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 600 | 1.0 | 1.0 | 0 | 0.80 |
II | 600 | 0.40 | 0.40 | 0.80 | |
III | 575 | 0 | 0 | 1.0 | |
A. 达平衡时,容器II中![]() 比容器I中的大
比容器I中的大
B. 达平衡时,容器Ⅲ中的正反应速率比容器I中的大
C. 达平衡时,容器I与容器II中的总压强之比为5:6
D. 达平衡时,容器Ⅲ中c(CH3COOH)小于0.80mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com