
【化学与技术】
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
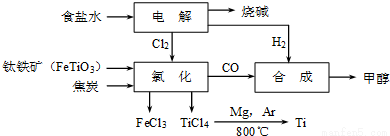
请回答下列问题:
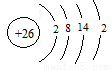
(1)Fe的原子序数为26,其最外层电子数为2,请写出铁原子结构示意图____。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)氯碱厂获得Cl2的离子方程式为 。
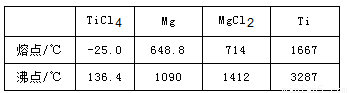
(4)由TiCl4→Ti反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
(5)为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为 时,理论上Cl2的利用率最大。
(1)
(2)2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO
2FeCl3+2TiCl4+6CO
(3)2Cl- + 2H2O  H2↑ + Cl2↑ + 2OH-
H2↑ + Cl2↑ + 2OH-
(4)1412
(5)7:1
【解析】(1)铁位于元素周期表的第4周期第Ⅷ族,是过渡金属元素的代表,原子序数为26,电子层结构为
(2)从图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO;
2FeCl3+2TiCl4+6CO;
(3)工业上用电解饱和NaCl溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。阳极反应:2Cl--2e-=Cl2↑(氧化反应);阴极反应:2H++2e-=H2↑(还原反应);因此,电解饱和食盐水的总反应可以表示为:2Cl-+2H2O H2↑ + Cl2↑ + 2OH-;
H2↑ + Cl2↑ + 2OH-;
(4)Ar气中进行防止钛、镁被氧化;控制温度使TiCl4、Mg、MgCl2转化为蒸气,Ti不熔化,故温度略高于1412℃;
(5)根据2Cl-+ 2H2O H2↑ + Cl2↑ + 2OH-;再根据图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2
H2↑ + Cl2↑ + 2OH-;再根据图示可知氯化时的反应物为FeTiO3、C、Cl2,生成物为FeCl3、TiCl4、CO,再根据得失电子和原子守恒即可得出该反应的方程式为2FeTiO3+6C+7Cl2 2FeCl3+2TiCl4+6CO,得出关系式2FeTiO3 ~ 7Cl2 ~ 14NaCl,所以为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为7:1时,理论上Cl2的利用率最大。
2FeCl3+2TiCl4+6CO,得出关系式2FeTiO3 ~ 7Cl2 ~ 14NaCl,所以为了减少产业链生产时产生的工业三废对环境的威胁,当NaCl与FeTiO3的物质的量之比为7:1时,理论上Cl2的利用率最大。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
关于下列各图的叙述,正确的是
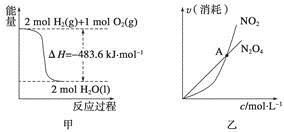
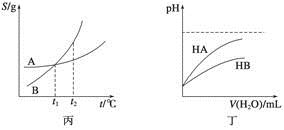
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1 ℃升温至t2 ℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是
待测气体 | 部分电极反应产物 |
NO2 | NO |
Cl2 | HCl |
CO | CO2 |
H2S | H2SO4 |
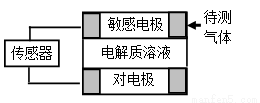
A.上述气体检测时,敏感电极均作电池正极
B.检测Cl2气体时,敏感电极的电极反应为:Cl2 + 2e-= 2Cl-
C.检测H2S气体时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH-
D.检测H2S 和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测12 题型:选择题
有机化学中物质的结构可用键线式表示,如CH2===CHCH2Br可表示为 。科学家曾合成具有独特结构的化合物1和2,发现化合物1加热后可得化合物2。以下关于化合物1和2的说法正确的是
。科学家曾合成具有独特结构的化合物1和2,发现化合物1加热后可得化合物2。以下关于化合物1和2的说法正确的是
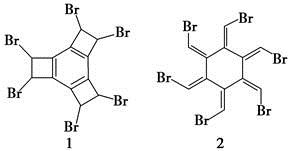
A.化合物1和2均属于芳香族化合物
B.化合物1和2均能与溴水反应而使其褪色
C.化合物1和2互为同分异构体
D.化合物1中所有原子均处于同一平面
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列化学用语表示正确的是
A.表示氢气燃烧热的热化学方程式:2H2(g)+O2(g)= 2H2O(1)△H= -571.6kJ/mol
B.肥皂(主要成分为RCOONa)的水溶液显碱性:RCOO-+H2O RCOOH+OH-
RCOOH+OH-
C.实验室制氯气的离子方程式:MnO2+4H++4Cl-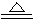 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.乙酸与乙醇反应的化学方程式:CH3CO18OH+C2H5OH CH3CO18OC2H5+H2O
CH3CO18OC2H5+H2O
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列与有机物结构、性质相关的叙述正确的是
A.乙醇分子和水分子中都含有羟基,均可与金属钠反应生成氢气
B.苯和乙烯分别与酸性高锰酸钾溶液混合,现象相同
C.淀粉和纤维素均为多糖,属于同分异构体
D.石油的分馏、煤的干馏、煤的气化和液化均为物理变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
右图所示装置中,a、b、c、d、e、f均为惰性电极,电解质溶液均足量。接通电源后,d极附近显红色。下列说法正确的是
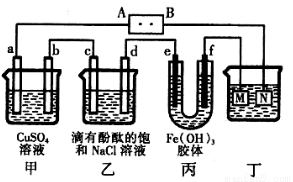
A.电源B端是正极
B.a、c电极均有单质生成,其物质的量之比为2:1
C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液
D.f极附近变红,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合4 题型:简答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu + H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
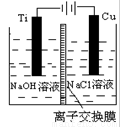
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: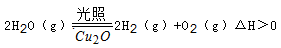
水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度T2小于T1
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com