
| A. | H2O | B. | Zn | C. | KCl | D. | KI |
分析 因碘易升华可精制碘,须使ICl、IBr中的Cl、Br变为难挥发性的物质,而使其中的+1价的碘被还原为I2,同时加入的物质和碘(I2)不反应,以此来解答.
解答 解:A.加入水,导致碘难以升华,且水中溶解部分碘,不符合分离、提纯的目的,故A错误;
B.加入Zn,在加热条件下生成ZnI,影响被提纯的物质,不符合提出的原则,故B错误;
C.加入KCl与杂质不反应,不能起到除杂的目的,故C错误;
D.加入KI发生:反应为IBr+KI=I2+KBr,ICl+KI=I2+KCl,加热时I2升华与KCl、KBr分离,故D正确.
故选D.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握发生的反应、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意除杂的原则,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气均为化石燃料,它们属于可再生资源 | |
| B. | 大自然利用太阳能最成功的是植物的光合作用 | |
| C. | 石油的分馏、催化裂化、裂解等石油加工方法,其目的均为得到更多的汽油 | |
| D. | 化肥的大量使用不会造成环境污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学研究会造成严重的环境污染,危害人们的生活 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用大量木材作燃料可以缓解当前能源不足问题 | |
| D. | 对于常见的大多数金属,其金属活动性越强,冶炼就越困难 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.2g甲酸中,所含化学键的数目为0.8 NA | |
| B. | 常温下,28g Fe与足量的浓硝酸反应,转移的电子数为1.5NA | |
| C. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为NA | |
| D. | 标准状况下,22.4L己烷所含有的分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和H2 | B. | C6H12O6 | C. | CH2O2 | D. | C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
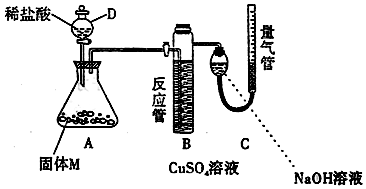
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:
在一固定容积的密闭容器中,进行如下反应:CO+H2O(g)?CO2+H2.其化学平衡常数K与温度T的关系如表:| T(℃) | 700 | 800 | 850 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
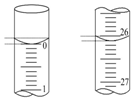 某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:
某学生用0.100 0mol/L的NaOH标准溶液滴定未知浓度的盐酸,其操作可分为如下几步:| 滴定 次数 | 盐酸溶液/mL | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前 | 滴定 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com