
【题目】 粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_____________,产物中的单质B是_____________。
(2)②中所发生的各反应的化学方程式是_______________________。
(3)③中所发生的各反应的离子方程式是_________________________。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为__________,c(Fe2+)为__________。
【答案】
(1)加少量KClO3,插上镁条并将其点燃;Fe;
(2)MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O;
(3)Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
(4)0.67mol/L;2.33mol/L。
【解析】
试题分析:①铝热反应本质是置换反应,金属性Al>Fe,所以发生Al与Fe2O3反应,置换出铁,即B为Fe;②MgO与盐酸反应生成氯化镁与水,Fe2O3与盐酸反应生成氯化铁与水,溶液C中含有MgCl2、FeCl3;③单质B和溶液C反应,放出1.12L(标准状况)气体,说明生成氢气,说明②中盐酸过量,溶液C为MgCl2、FeCl3、HCl混合溶液,反应同时生成溶液D,还残留有固体物质B,说明Fe有剩余,结合④用KSCN溶液检验时,溶液D不变色,说明D溶液不含铁离子,则D中溶质为MgCl2、FeCl2。
(1)①中引发铝热反应操作为:加少量KClO3,插上镁条并将其点燃,产物中的单质B是Fe,故答案为:加少量KClO3,插上镁条并将其点燃;Fe;
(2)氧化镁与盐酸反应生成氯化镁与水,氧化铁与盐酸反应生成氯化铁与水,反应方程式为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O,故答案为:MgO+2HCl=MgCl2+H2O、Fe2O3+6HCl=2FeCl3+3H2O;
(3)Fe与盐酸反应生成氯化亚铁与氢气,反应离子方程式为:Fe+2H+=Fe2++H2↑,铁与氯化铁反应生成氯化亚铁,反应离子方程式为Fe+2Fe3+=3Fe2+,故答案为:Fe+2H+=Fe2++H2↑、Fe+2Fe3+=3Fe2+;
(4)令MgO和Fe2O3的物质的量分别为xmol,则40x+160x=20,解得x=0.1,溶液D为MgCl2、FeCl2的混合溶液,根据镁元素守恒可知,n(Mg2+)=n(MgO)=0.1mol,所以c(Mg2+)=![]() =0.67mol/L;根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),所以2×0.67mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.33mol/L,故答案为:0.67mol/L;2.33mol/L。
=0.67mol/L;根据电荷守恒溶液中2c(Mg2+)+2c(Fe2+)=c(Cl-),所以2×0.67mol/L+2c(Fe2+)=6mol/L,解得c(Fe2+)=2.33mol/L,故答案为:0.67mol/L;2.33mol/L。


科目:高中化学 来源: 题型:
【题目】唐代诗人杜牧有首诗为“银烛秋光冷画屏,轻罗小扇扑流萤。天街夜色凉如水,卧看牵牛织女星。”,其中的流萤是指飞舞的萤火虫,萤火虫发光所需的能量直接来自于 ( )
A.C6H12O6的分解 B.蛋白质的分解
C.ATP的水解 D.脂肪的分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)若某药品质量约为32.0g, 托盘天平准确称其质量,若用↓表示在右盘放上砝码,用↑表示将砝码取下,在下列表格的空格内,用↓和↑表示相应砝码的放上或取下.
50g | 20g | 20g | 10g | 5g |
(2)配制500mL 0.1mol.L-1 Na2CO3溶液,图中操作②中应该填写的数据为__________,实验操作的先后顺序为________________ (填编号)。
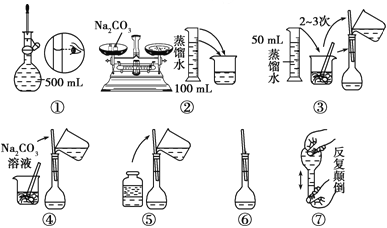
(3)在配制一定物质的量浓度的溶液时,用“偏高、偏低、无影响”表示下列操作对所配溶液浓度的影响。
①用量筒取液态溶质,读数时,俯视量筒,所配制溶液的浓度___________
②将量取液态溶质的量筒用水洗涤,洗涤液倒入容量瓶,所配制溶液的浓度___________
③定容摇匀后,有少量溶液外流,对所配制溶液的浓度___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以物质的量为中心的相关计算,已知阿伏伽德罗常数为NA.
(1)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是___________,在相同温度和相同压强条件下,体积最大的是___________。
(2)73.0g HCl气体中含有_______个分子、________个原子、______个质子、_________个电子,标况下体积约为_______L
(3)23.75 g某+2价金属的氯化物(MCl2)中含有3.01×1023个Cl-,则MCl2的摩尔质量为________, MCl2的相对分子质量为________,M的相对原子质量为________。
(4)将0.5L1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L0.1mol·L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3·H2O的变化趋势如图所示(不考虑溶液体积变化和氨的挥发),下列说法正确的是

A.在M点时,n(OH-)-n(H+)=(a-0.05)mol
B.M点溶液中水的电子程度比原溶液的大
C.随着NaOH的加入,c(H+)/c(NH4+)不断增大
D.当n(NaOH)=0.mol时,c(OH-)=c(Cl-)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知lg2=0.3, KSP[Cr(OH)3]=6.4×10-31。某工厂进行污水处理时,要使污水中的Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5时,可以认为Cr3+沉淀完全,溶液的pH至少为
A.4.4 B.5.6 C.6.7 D.8.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com