现代高速发展的工农业生产中,氮元素及其化合物在某些领域有着重要的作用.请回答下列问题:
(1)氮元素基态原子的价电子排布式为
(2)氮气化学性质相对稳定,是由于分子中氮原子之间存在着
个σ键和
π键
(3)在周期表中,磷与氧和氮元素相邻,试比较:
氮原子的第一电离能
(填大于、小于或等于)氧原子的第一电离能,原因是
(4)工业生产中,以液态形式储存氮的氢化物,其原因是:
(5)2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺(
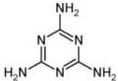
).
列关于三聚氰胺分子的说法中正确的是
.
A.所有碳原子采用sp
2杂化,所有氮原子采用sp
3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高.

 ).
).
