
A.混合气体的密度 B.混合气体的压强
C.混合气体的总物质的量 D.混合气体的平均相对分子质量
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
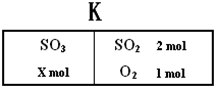 如图所示,保持反应过程中温度不变,在一个容积为4L的密闭容器中,左室加入X molSO3,右室加入2 molSO2和1molO2,中间是个可移动的隔板,在少量催化剂存在下分别发生反应:
如图所示,保持反应过程中温度不变,在一个容积为4L的密闭容器中,左室加入X molSO3,右室加入2 molSO2和1molO2,中间是个可移动的隔板,在少量催化剂存在下分别发生反应:查看答案和解析>>
科目:高中化学 来源: 题型:
(14分) 硫酸是工业生产中一种重要的化工产品,我国工业生产硫酸的主要方法是接触法,主要原料为黄铁矿,请回答下列问题:
(1)已知煅烧黄铁矿的化学方程式为 4FeS2 + 11O2 2Fe2O3+ 8SO2
该反应中氧化剂和氧化产物之比为 ;标准状态下得到4.48升SO2 时,一共转移了 mol e- 。(每空3分)
(2)已知温度、压强对SO2平衡转化率的影响如下表所示:根据上表回答,SO2转化到SO3的
最佳反应条件是 。(每空2分)
A.400-500℃ 0.1 MPa B.400℃ 10 MPa
C.500℃ 10MPa D.400-500℃ 1 MPa
(3)在一定条件下,1mol SO2完全转化成SO3气体时放出热量为Q1KJ,写出该反应的热化学方程式: 。若在该条件下将2 molSO2 放入一定容积的密闭容器中,一段时间后测得反应放出热量为Q2 KJ,则此时SO2的转化率为 (用含Q1、Q2代数式表示)。(每空2分)
(4)市售浓硫酸的密度是1.84 g / cm3、质量分数为98 % ,若用H2SO4· XH2O来表示这种浓硫酸,则X为 。(每空2分)
查看答案和解析>>
科目:高中化学 来源: 题型:
将4 molSO2和2mol O2气体在2 L的密闭容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g)2SO3 (g)。若经过2s后测得SO3的浓度为0.6 mol/ L,试计算:
(1)用氧气表示该反应2s内的平均速率;
(2)2s末SO2的转化率;
(3)2s末O2浓度。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市闵行区高三下学期三模考试化学试卷(解析版) 题型:选择题
已知:S(s)+O2(g)→SO2(g) +297.16kJ,2SO2(g)+O2(g)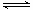 2SO3(g)+196.6
kJ,下列说法正确的是
2SO3(g)+196.6
kJ,下列说法正确的是
A.1 molSO2(g)的能量总和大于lmol S(s)和l molO2(g)的能量总和
B.将2 molSO2(g)与l molO2(g)在一定条件下充分反应,放出196.6kJ的热量
C.S(g)+O2(g) SO2(g)+Q,Q值小于297.16 kJ
SO2(g)+Q,Q值小于297.16 kJ
D.当l mol S(s)完全转化为SO3(g)时(假设无热量损失),放出395.46kJ的热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com