
【题目】中药黄芩的有效成分之一——汉黄芩素具有抗病毒、抗肿瘤作用。合成汉黄芩素的中间体M的路线如下:
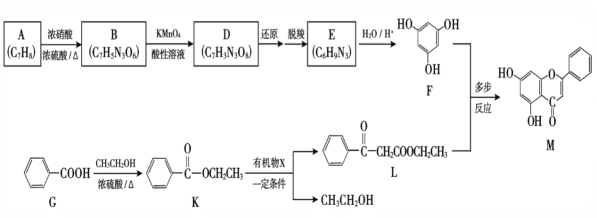
(1)A属于芳香烃,A的名称是______。
(2)由A生成B的化学方程式是_______。
(3)D中含有的官能团是________。
(4)E的结构简式是_______。
(5)K与X在一定条件下转化为L, X的分子式是C4H8O2。
①有机物X的结构简式是______。
②符合下列条件的K的同分异构体有_____种。
a.含有苯环,能与NaHCO3反应生成CO2 b.苯环上的一氯代物有两种
(6)F与L合成M的步骤如下:

已知:
中间产物1和中间产物2的结构简式分别是_____、_____。
【答案】甲苯 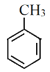 +3HNO3
+3HNO3 ![]()
 +3H2O —COOH、—NO2 (或羧基、硝基)
+3H2O —COOH、—NO2 (或羧基、硝基) ![]() CH3COOCH2CH3 4
CH3COOCH2CH3 4 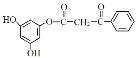
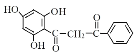
【解析】
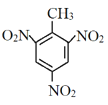
根据由A到F的转化关系,结合F的结构式,以及A到E的分子式,E在酸性条件下与水发生取代反应,生成F,结合E的分子式,转化过程为E中苯环上的氨基转化为羟基,则E的结构式为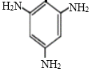 ,D进行还原脱羧生成E,结合D的分子式,转化过程为D中的硝基被还原转化为氨基,并将羧基脱去,则D的结构简式为
,D进行还原脱羧生成E,结合D的分子式,转化过程为D中的硝基被还原转化为氨基,并将羧基脱去,则D的结构简式为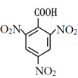 ,B被酸性高锰酸钾溶液氧化为D,结合B的分子式,根据B、D前后原子数目变化,转化过程为B中的甲基被酸性高锰酸钾溶液氧化为羧基,则B的结构简式为
,B被酸性高锰酸钾溶液氧化为D,结合B的分子式,根据B、D前后原子数目变化,转化过程为B中的甲基被酸性高锰酸钾溶液氧化为羧基,则B的结构简式为 ,A与浓硝酸在浓硫酸作催化剂加热条件下发生取代反应生成三硝基甲苯,则A为甲苯,结构简式为
,A与浓硝酸在浓硫酸作催化剂加热条件下发生取代反应生成三硝基甲苯,则A为甲苯,结构简式为 ;G在浓硫酸加热条件下发生酯化反应生成K,K与有机物X在一定条件下反应生成乙醇和L,结合K、L的结构式变化,有机物X为CH3COOCH2CH3,据此分析解答(1)~ (5)小题;
;G在浓硫酸加热条件下发生酯化反应生成K,K与有机物X在一定条件下反应生成乙醇和L,结合K、L的结构式变化,有机物X为CH3COOCH2CH3,据此分析解答(1)~ (5)小题;
(6)根据流程及产物的结构式分析可得,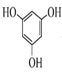 与
与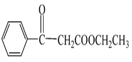 取代反应生成
取代反应生成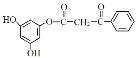 ,则中间产物1为
,则中间产物1为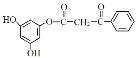 ,中间产物1与AlCl3在高温下发生已知信息的反应转化为中间产物2为
,中间产物1与AlCl3在高温下发生已知信息的反应转化为中间产物2为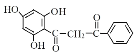 ,中间产物2在一定条件下与氢气发生加成反应生成
,中间产物2在一定条件下与氢气发生加成反应生成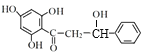 ,该物质在一定条件下发生分子内脱水生成目标产物
,该物质在一定条件下发生分子内脱水生成目标产物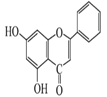 ,据此分析解答。
,据此分析解答。
(1)A属于芳香烃,结构简式为 ,名称是甲苯;
,名称是甲苯;
(2)甲苯与浓硝酸在浓硫酸作催化剂加热条件下发生取代反应,生成三硝基甲苯,化学方程式是 +3HNO3
+3HNO3 ![]()
 +3H2O
+3H2O
(3)根据分析,D的结构简式为 ,含有的官能团是—COOH、—NO2(或羧基、硝基);
,含有的官能团是—COOH、—NO2(或羧基、硝基);
(4)根据分析,E的结构式为 ;
;
(5)①根据上述分析,有机物X的结构简式是CH3COOCH2CH3;
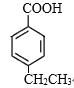
②K的结构简式为![]() ,其同分异构体含有苯环,能与NaHCO3反应生成CO2,说明结构中含有羧基,苯环上的一氯代物有两种,说明分子的苯环上只有两种不同环境的氢原子,符合下列条件的K的同分异构体有
,其同分异构体含有苯环,能与NaHCO3反应生成CO2,说明结构中含有羧基,苯环上的一氯代物有两种,说明分子的苯环上只有两种不同环境的氢原子,符合下列条件的K的同分异构体有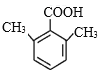 、
、 、
、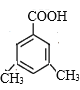 、
、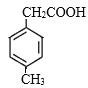 共4种;
共4种;
(6)根据流程及上述分析可得,中间产物1为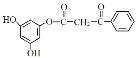 ,中间产物1与AlCl3在高温下发生已知信息的反应转化为中间产物2为
,中间产物1与AlCl3在高温下发生已知信息的反应转化为中间产物2为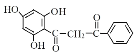 。
。


 教学练新同步练习系列答案
教学练新同步练习系列答案科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是________。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
A.达到平衡时,4v(O2)正=5v(NO)逆
B.达到平衡状态后,NH3 、O2 、NO 、H2O(g)的物质的量保持不变。
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为硬脂酸甘油酯在碱性条件下水解的装置图。进行皂化反应的步骤如下:
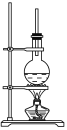
(1)在烧瓶中装入7~8 g硬脂酸甘油酯,然后加入2~3 g的NaOH、5 mL H2O和10 mL酒精。加入酒精的作用是________________________________________________________。
(2)图中长玻璃导管的作用是_______________________________________。
(3)该反应的化学方程式是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.28g乙烯与丙烯组成的混合物中含碳碳双键的数目为NA
B.2mol冰醋酸与4mol乙醇一定条件下充分反应,生成乙酸乙酯个数为2NA
C.室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
D.标准状况下11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素在日常生活中有广泛的应用。
(1)金属钒在材料科学上有重要作用,被称为“合金的维生素”,基态钒原子的价层电子的排布式为__;基态Mn原子核外有__个未成对电子,M层的电子云有__种不同的伸展方向。金属锰可导电,导热,具有金属光泽,有延展性,这些性质都可以用“__理论”解释。
(2)第四周期元素的第一电离能随原子序数增大,总趋势是逐渐增大的,但Ga的第一电离能明显低于Zn,原因是__。
(3)NO![]() 与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO
与钴盐形成的配离子[Co(NO2)6]3-可用于检验K+的存在。配位体NO![]() 的中心原子的杂化形式为__,空间构型为__。大π键可用符号
的中心原子的杂化形式为__,空间构型为__。大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n为各原子的单电子数(形成σ键的电子除外)和得电子数的总和(如苯分子中的大π键可表示为![]() ,则NO
,则NO![]() 中大π键应表示为__。
中大π键应表示为__。
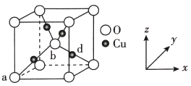
(4)铜与氧可形成如图所示的晶胞结构,其中Cu均匀地分散在立方体内部,a、b的坐标参数依次为(0,0,0)、(![]() ,
,![]() ,
,![]() ),则d点的坐标参数为__,已知该晶体的密度为ρgcm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。
),则d点的坐标参数为__,已知该晶体的密度为ρgcm-3,NA是阿伏伽德罗常数的值,则晶胞参数为__pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。25℃时,向浓度均为0.01mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成____________沉淀(填化学式),生成该沉淀的离子方程式为______________,当两种沉淀共存时,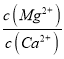 __________(保留两位有效数字)。
__________(保留两位有效数字)。
(2)25℃时,向0.01mol/L的MgCl2溶液中,逐滴加入浓NaOH溶液,刚好出现沉淀时,溶液的pH为____________;当溶液中的离子浓度小于1×10-5mol/L时,认为该离子沉淀完全,当Mg2+完成沉淀时,溶液的pH为___________ (忽略溶液体积的变化,已知:![]() 。
。
(3)该温度下,反应Cu(OH)2+2H+![]() Cu2++2H2O的平衡常数K=_____________。
Cu2++2H2O的平衡常数K=_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com