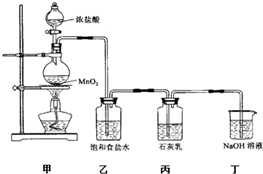
【答案】
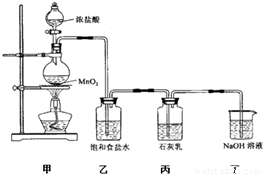
分析:(1)装置甲是氯气的发生装置,二氧化锰与浓盐酸在加热的条件下反应生成氯化锰、氯气、水;
(2)氯化氢易挥发,制取的氯气中含有HCl,影响氯气与碱反应产物的探究;
实验尾气中含有未反应的氯气,氯气有毒,直接排空,会污染空气,可以用氢氧化钠溶液吸收;
(3)根据过量计算判断盐酸、二氧化锰中哪一种剩余,根据不足的物质计算生成的氯气,在根据方程式计算生成的
Ca(ClO)
2质量;
(4)由题目信息可知,氯气和碱的反应为放热反应,温度过高,氯气和碱反应会生成氯酸盐,导致次氯酸盐的产率降低,故应将丙装置置于低温环境.
解答:解:(1)二氧化锰与浓盐酸在加热的条件下反应生成氯化锰、氯气、水,
反应方程式为:MnO
2+4HCl
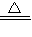
MnCl
2+Cl
2↑+2H
2O;
故答案为:MnO
2+4HCl

MnCl
2+Cl
2↑+2H
2O;
(2)氯化氢易挥发,制取的氯气中含有HCl,影响氯气与碱反应产物的探究,用饱和食盐水除去氯气中混有的氯化氢;
实验尾气中含有未反应的氯气,氯气有毒,直接排空,会污染空气,可以用氢氧化钠溶液吸收;
故答案为:除去氯气中混有的氯化氢;吸收Cl
2防止污染空气;
(3)8.7gMnO
2的物质的量为
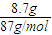
=0.1mol,根据方程式MnO
2+4HCl
MnCl
2+Cl
2↑+2H
2O可知,MnO
2完全反应需要HCl的物质的量为0.4mol,小于0.1L×12mol?L
-1=1.2mol,故二氧化锰完全反应,由方程式可知生成氯气0.1mol,由方程式2Cl
2+2Ca(OH)
2=CaCl
2+Ca(ClO)
2+2H
2O可知,0.1mol氯气完全反应生成0.05molCa(ClO)
2,
质量为0.05mol×143g.mol=7.15g;
故答案为:7.15g;
(4)由题目信息可知,氯气和碱的反应为放热反应,温度过高,氯气和碱反应会生成氯酸盐,导致次氯酸盐的产率降低,可以将丙装置浸在盛有冷水的水槽中降低温度;
故答案为:将丙装置浸在盛有冷水的水槽中.
点评:考查氯气的制取、氯气的性质、对反应装置的理解、反应条件的控制等,难度中等,注意(3)中过量计算.

 MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O; MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;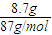 =0.1mol,根据方程式MnO2+4HCl
=0.1mol,根据方程式MnO2+4HCl MnCl2+Cl2↑+2H2O可知,MnO2完全反应需要HCl的物质的量为0.4mol,小于0.1L×12mol?L-1=1.2mol,故二氧化锰完全反应,由方程式可知生成氯气0.1mol,由方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O可知,0.1mol氯气完全反应生成0.05molCa(ClO)2,
MnCl2+Cl2↑+2H2O可知,MnO2完全反应需要HCl的物质的量为0.4mol,小于0.1L×12mol?L-1=1.2mol,故二氧化锰完全反应,由方程式可知生成氯气0.1mol,由方程式2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O可知,0.1mol氯气完全反应生成0.05molCa(ClO)2,

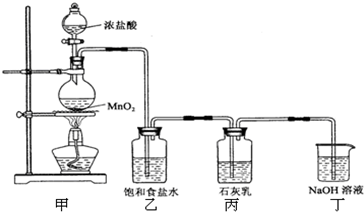
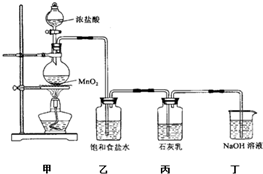 某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.
某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物. 某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物.
某兴趣小组设计了下列实验装置探究氯气与石灰乳反应的条件和产物. 5NaCl+NaClO3+3H2O为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:______.
5NaCl+NaClO3+3H2O为了提高Ca(ClO)2的产率,可对丙装置作适当改进.请你给出一种改进方法:______.