
| A��0.1 mol��L-1NH3?H2O��Һ�У� c (NH4+) < c (OH��) |
| B��0.1 mol��L-1NH4Cl��Һ�У�c(NH4+)+c(H+)��c(Cl-)+c(OH-) |
| C��0.1 mol��L-1Na2CO3��Һ�У�c((HCO3-)+c(CO3-)+ c (H2CO3)=" 0.1" mol��L-1 |
| D��Ũ�Ⱦ�Ϊ0.1 mol��L��1��NH4Cl��CH3COONH4��NH4HSO4��Һ��c(NH4+)��С˳��CH3COONH4> NH4Cl > NH4HSO4 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��V/4 mL | B��V/3 mL | C��V/5 mL | D�����ж� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������£�pH=1�Ĵ�����Һ�У�������ӵ���Ŀһ������0.1NA |
| B��22.4LCH4��CH3Cl�Ļ���������еķ�����ĿΪNA |
| C��5.6 g������0.1mol�����г��ȼ�գ�ʧȥ�ĵ�����Ϊ0.3NA |
| D��1mol������������й��õ��Ӷ���Ϊ3NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����>��>��>�� | B���٣���>��>�� |
| C����>�٣���>�� | D����>��>��>�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��NA������������NA���������ӵ���������4��5 |
| B��14g14C��12g12C��������������� |
| C������������0.23gNa���������ϴ�ЩС�ף�Ͷ������ˮ�У��ų��������������112mL |
| D�����³�ѹ�£�11.2LCO2��8.5gNH3������������ȣ���Ϊ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 ϡ����
ϡ����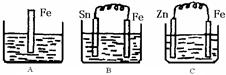
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| |
| ||||
| �������ʵ���������/% | 36.5 | 40 | 60 | 63 | |
| ���ʵ���Ũ��/mol��L1 | 11.8 | 14.3 | 10.6 | 13.8 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com