
【题目】下列说法中,正确的是( )
A. 若将15P原子的电子排布式写成1s22s22p63s23p3p,它违背了泡利原理
B. 金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
C. 石墨、新型高分子导电材料、聚乙烯、金属晶体均含有金属键
D. 乳酸[CH3CH(OH)COOH]中存在2个手性碳原子
【答案】B
【解析】A、泡利原理是每个轨道最多容纳两个电子,且自旋的方向相反,洪特规则是同一能级上电子优先单独占据一个轨道,且自旋反应相同,因此1s22s22p63s23p3p违背了洪特规则,故A错误;B、一般不同晶体熔沸点高低顺序是原子晶体>离子晶体>分子晶体,金刚石和SiC属于原子晶体,原子晶体熔沸点高低判断,一般通过键长比较,键长越短,熔沸点越高,C的原子半径小于Si,因此金刚石中C-C键长小于SiC中Si-C键长,即金刚石的熔点高于SiC,NaF和NaCl属于离子晶体,离子晶体一般通过晶格能,晶格能越大,熔沸点越高,晶格能与离子所带电荷数和离子半径有关,所带电荷数越多,半径越小,晶格能越大,熔沸点越高,即F-的半径小于Cl-,因此NaF熔沸点高于NaCl,H2O和H2S属于分子晶体,H2O中含有分子间氢键,即H2O的熔点高于H2S,因此熔点顺序是金刚石>SiC>NaF>NaCl>H2O>H2S,故B正确;C、聚乙烯中不含金属键,故C错误;D、手性碳原子是连有4个不同的原子或原子团,乳酸结构式为 ,根据手性碳原子定义,只有1个手性碳原子,故D错误。
,根据手性碳原子定义,只有1个手性碳原子,故D错误。


科目:高中化学 来源: 题型:
【题目】下列关于金属说法正确的是
A. 自然界中的金属元素都以化合态存在
B. 金属钠着火,可以用水灭火
C. 铁在潮湿的空气中很稳定,但红热的铁丝可与水蒸气反应
D. Al与NaOH溶液的反应中,每转移3mole-,就生成1.5molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复分解反应是中学化学中常见的一种反应类型。复分解反应中,元素的化合价都没发生变化,都不属氧化还原反应。
(1)复分解反应存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐。已知相同物质的量浓度的溶液,pH大小关系是pH(Na2CO3)>pH(NaClO)>pH(NaHCO3)>pH(NaHS O3)。
①写出向NaClO溶液中通入少量CO2的化学方程式______________________。
②将混有CO2气体的SO2气体,通入NaHSO3饱和溶液,___________(填“能”或“不能”)除去CO2气体。
(2)复分解反应从形式上看,是一种相互交换成分的反应,在有机反应中,也存在类似形式的反应——“烯烃的复分解”反应。

如果用重氢(D)标记过的烯烃CD3CD![]() CDCD3和烃CH3CH
CDCD3和烃CH3CH![]() CHCH3进行反应,其化学方程式是______________________。
CHCH3进行反应,其化学方程式是______________________。
(3)复分解反应的发生还遵循向生成沉淀、气体、难电离物质的方向进行。
①甲同学认为CuSO4+H2S![]() H2SO4+CuS↓不能发生,因为该反应违背了“较强酸制较弱酸”的原则。请你判断甲同学的观点是否正确,并做出解释:________________。
H2SO4+CuS↓不能发生,因为该反应违背了“较强酸制较弱酸”的原则。请你判断甲同学的观点是否正确,并做出解释:________________。
②乙同学认为,BaSO3可溶于酸,SO2通入Ba(NO3)2溶液中不发生化学反应,但经过实验探究发现,有白色沉淀生成,请你写出相关反应的离子方程式_____________。
(4)电解是一种在通电作用下的氧化还原反应。用电解法可将某工业废水中的CN-转变为N2,装置如上图所示。电解过程中,阴极区电解质溶液的pH将_____________(填“增大”“减小”或“不变”)。阳极的电极反应式为______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓硝酸中放入铜片:
(1)开始反应的化学方程式为 , 实验现象为 .
(2)若铜有剩余,则反应将要结束时的反应方程式为 .
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是 .
(4)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生5.6L(标准状况)气体.则所消耗的HNO3的物质的量为 , 其中显氧化性的硝酸的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用,实验小组进行碘单质的制备。
【查阅资料】碱性条件下,I2会发生歧化反应生成I-和IO3-,酸性条件下, I-和IO3-又会发生归中反应生成I2;碘在水中的溶解度为0.029g。
【碘的制取】以海带为原料,按照以下步骤进行实验。

(1)将海带灼烧成灰后再用水浸取,目的是_______________。
(2)步骤B发生的反应是“氧化”,这一操作中可供选用的试剂: ①Cl2;②Br2;③稀硫酸和H2O2,从无污染角度考虑,你认为合适试剂是______(填编号),反应中I-转化为I2 的离子反应方程式为_______________。
(3)步骤C中使用的起到分离作用的仪器是_____________,使用该仪器时,第一步操作是_______________。
(4)有同学查资料后发现CCl4有毒,提议用乙醇代替,请判断该提议是否可行,原因是_______________。
【碘的分离】得到含I2的CCl4溶液后,利用右图装置进行碘的提取并回收溶剂。

(5)图中有两处明显错误,分别是①_________;②_________。
(6)对实验装置的错误改正之后进行分离操作。预期锥形瓶中得到无色的CCl4,实验结果锥形瓶中得到紫红色液体,请分析出现该实验结果的原因____________,为了保证实验成功,请提出改进方案:___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( ) 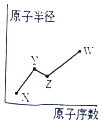
A.Y、Z、W处于同一周期
B.X、Y、Z、W的原子序数递增
C.X、W可形成化学式为XW的离子化合物
D.简单离子半径是Z大于W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去甲烷气体中混有的乙烯得到纯净的甲烷,最好依次通过盛有( )试剂的装置.
A.澄清石灰水、浓H2SO4
B.酸性KMnO4溶液、浓H2SO4
C.溴水、浓H2SO4
D.CCl4、碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用萃取法从碘水中分离碘,所用萃取剂应具有的性质是( ) ①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
A.①②⑤
B.②③④
C.①③⑤
D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com