
【题目】用块状碳酸钙与稀盐酸反应制取二氧化碳气体,下列可以降低反应速率的措施是( )
A. 加热B. 加入浓盐酸C. 加入蒸馏水D. 减少块状碳酸钙固体质量
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A. 1mol甲基(-CH3)含有的质子数为9NA
B. 31gP4(![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C. 铜与浓硝酸反应生成1 moI NO2转移的电子数为NA
D. 22.4L(标准状况)氯气溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色玻璃以其优异的性能将成为市场的新宠,如图所示五层膜的玻璃电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。(已知:WO3和 Li4 Fe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色)下列有关说法正确的是
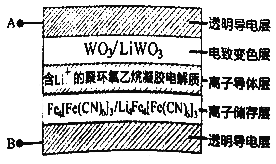
A. 当A外接电源负极时,此时Li+得到电子被还原
B. 当A外接电源正极时,膜的透射率降低,可以有效阻挡阳光
C. 当B外接电源正极时,离子导体层中Li+向下迁移
D. 当B外接电源负极时,离子储存层发生反应为:Fe4[Fe(CN)6]3+4Li++4e-=Li4Fea[Fe(CN)6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生下述反应,并于10min时达到平衡:PCl3(g)+Cl2(g)![]() PCl5(g) △H<0,有关数据如下:
PCl5(g) △H<0,有关数据如下:
PCl3(g) | Cl2(g) | PCl5(g) | |
初始浓度(mol/L) | 2.0 | 1.0 | 0 |
平衡浓度(mol/L) | c1 | c2 | 0.4 |
下列判断不正确的是
A. 10 min内,v(Cl2)=0.04 mol/(Lmin)
B. 当容器中Cl2为1.2 mol时,反应达到平衡
C. 升高温度,反应的平衡常数增大,平衡时PCl3的物质的量浓度<1.6mol/L
D. 平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气的主要成分有CO、SO2、NO、NO2等。
(1)利用氨水可以将SO2、氮氧化物吸收,原理如下图所示。
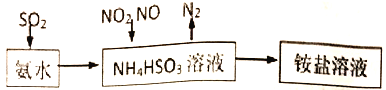
①25℃时,在pH=5的 NH4HSO3溶液中,c(SO32-)+c(NH3·H2O)-c(H2SO3)=__________mol/L(填确值)
②请写出NO2和NO按体积比1:1被吸收时反应的离子方程式_____________________。
(2)科研工作者目前正在尝试以二氧化钛(TiO2)催化分解汽车尾气的研究。
①已知:2NO(g)+O2(g)=2NO2(g) △H1=-113.0kJ·mol-1
3NO2(g)+H2O(g)=2HNO3(g)+NO(g) △H2=-138.0 kJ·mol-1
TiO2催化尾气降解原理可表示为:2COg)+O2(g)![]() 2CO2(g) △H3
2CO2(g) △H3
则2H2O(g)+4NO(g)+3O2(g)![]() 4HNO3(g) △H4=______________________。
4HNO3(g) △H4=______________________。
②在O2、H2O(g)浓度一定条件下,模拟CO、NO的降解,得到其降解率(即转化率)如图1所示。请解释T1后NO降解率下降的可能原因______________________。
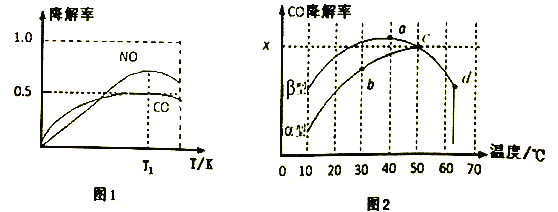
(3)沥青混凝土也可降解CO。如图2为在不同颗粒间隙的沥青混凝土(α、β型)在不同温度下,反应相同时间,测得CO降解率变化。结合如图回答下列问题:
①已知在50℃时在α型沥青混凝土容器中,平衡时O2浓度为0.01mol·L-1,求此温度下CO降解反应的平衡常数____________________________________________。(用含x的代数式表示)
②科研团队以β型沥青混凝土颗粒为载体,将TiO2改为催化效果更好的TiO2纳米管,在10℃~60℃范围内进行实验,请在如图中用线段与“![]() ”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
”阴影描绘出CO降解率随温度变化的曲线可能出现的最大区域范围(在图中画出)。____________
(4)TiO2纳米管的制备是在弱酸性水溶液中以金属钛为阳极进行电解,写出阳极的电极反应式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是黄绿色有强烈刺激性气味的剧毒气体,是重要的工业原料。回答下列问题:
(1)将钠切去氧化层并用滤纸吸干煤油,在石棉网上微热至熔化后,立即用盛满氯气的集气瓶倒扣在其上方。现象是____________,该反应中反应物的能量______________(填“高于”或“低于”)生成物的能量。
(2)向盛有KI溶液的试管中加入少许CCl4后滴加新制的氯水,振荡后静置,CCl4层变成紫红色,用离子方程式解释:____________________________________________________。
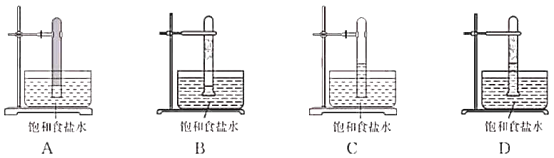
(3)光照下Cl2可与CH4反应。写出生成一氯甲烷的化学方程式:___________________。实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。

光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是_________(填标号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生课外活动小组为测定钠元素的相对原子质量,设计的装置如图所示,该装置(包括水和干燥剂)的总质量为ag,从实验室取出bg(不足量)钠放入水中,塞紧瓶塞,完全反应后再称量此装置的总质量为cg。试回答:

(1)实验室取用一小块钠,需要用到__________________实验仪器。
(2)此干燥管的作用是________________________;若此钠块有极少量被氧化,则测出的相对原子质量会比实际相对原子质量________(填“偏大”、“偏小”或“不变”)。
(3)有甲同学建议在图中干燥管上再连一同样干燥管,其目的是____________________,计算钠的相对原子质量的表达式为____________________。
(4)有乙同学为避免由于行动不够迅速产生偏差,又建议在集气瓶中再加入一定量煤油,其目的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NH3和HCl都是能用来做喷泉实验的气体,若在相同条件下用等体积烧瓶各收集满NH3和HCl气体,进行如图所示实验(两烧瓶内充满溶液且不考虑溶质的扩散)。下列说法错误的是
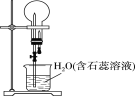
A. NH3和HCl分别形成蓝色、红色喷泉
B. 制备干燥的NH3和HCl,所需的干燥剂分别是碱石灰、浓硫酸
C. 若烧瓶中改为NO2,则所得溶液溶质的物质的量浓度与前两者不同
D. 去掉装置中的胶头滴管,改为单孔塞,也可引发喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料制备亚硝酸钠的装置如图所示(A中加热装置省略)。
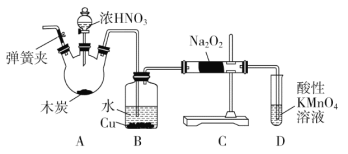
已知:室温下,①2NO+Na2O2=2NaNO2;
②3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O;
③酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+。
请按要求回答下列问题:
(1)A装置中反应的化学方程式为______________________________。
(2)B装置中主要的现象是______________________________。
(3)检验C装置产物中有亚硝酸钠的方法是_____________________________。
(4)D装置中反应的离子方程式为_________________________________。
(5)预测C中反应开始阶段,固体产物除NaNO2外,还含有的副产物有Na2CO3和________。为避免产生这些副产物,应在B、C装置间增加装置E,则E中盛放的试剂名称为________。
(6)检查装置气密性并装入药品后,以下实验操作步骤正确的顺序为____________(填序号)。
a.打开弹簧夹,向装置中通入N2
b.点燃酒精灯
c.向三颈烧瓶中滴加浓硝酸
d.熄灭酒精灯
e.关闭分液漏斗欧旋塞
f.停止通入N2
(7)利用改进后的装置,将7.8gNa2O2完全转化为亚硝酸钠,理论上需要木炭______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com