
常温下,下列各组离子在指定溶液中一定能大量共存的是 ( )。
A.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42-
B.c(H+)<c(OH-)的溶液中:Na+、K+、SO42-、ClO-
C.能使pH试纸变红的溶液中:K+、Ba2+、AlO2-、Cl-
D.pH=0的溶液中:Mg2+、Na+、F-、SO42-
科目:高中化学 来源:2014年高考化学苏教版总复习 1-2 物质的量、物质的聚集状态练习卷(解析版) 题型:选择题
下列说法中错误的是( )
A.从1 L 1 mol·L-1的NaCl溶液中取出10 mL,其浓度仍是1 mol·L-1
B.配制0.5 L 10 mol·L-1的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol·L-1 BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g· cm-3)与10 mL 18.4 mol·L-1硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习3-1钠、镁及其化合物练习卷(解析版) 题型:填空题
镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:
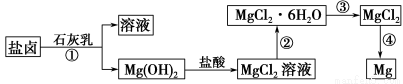
回答下列问题:
(1)工业上从盐卤中获取Mg(OH)2用石灰乳而不用NaOH溶液的原因是 。
(2)从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经 、 (填操作方法)可得纯净的Mg(OH)2。
(3)下图是该兴趣小组设计进行过程③的实验装置图:
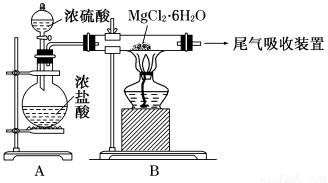
其中装置A的作用是 。
(4)写出过程④中发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-3-1氧化还原反应概念和规律练习卷(解析版) 题型:选择题
已知:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O,MnO2+4HCl MnCl2+Cl2↑+2H2O。其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6 mol·L-1)反应,MnO2需和浓盐酸(>8 mol·L-1)反应。根据以上信息,下列结论中不正确的是 ( )。
MnCl2+Cl2↑+2H2O。其中KMnO4和一般浓度的盐酸即可反应,K2Cr2O7需和较浓盐酸(>6 mol·L-1)反应,MnO2需和浓盐酸(>8 mol·L-1)反应。根据以上信息,下列结论中不正确的是 ( )。
A.上述反应均属于氧化还原反应
B.生成1 mol Cl2时,三个反应中转移的电子数相等
C.盐酸浓度越大,Cl-的还原性越强
D.氧化性:KMnO4>K2Cr2O7>Cl2>MnO2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-2电解质 离子反应练习卷(解析版) 题型:填空题
某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:
(1)不做任何实验就可以肯定原溶液中不存在的离子是 。
(2)取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是 ,有关的离子方程式为 。
(3)取(2)中的滤液,加入过量的稀氨水(NH3·H2O),出现白色沉淀,说明原溶液中肯定有 ,有关的离子方程式为 。
(4)原溶液可能大量存在的阴离子是下列的 。
A.Cl- B.NO3- C.CO32- D.OH-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:填空题
无机化合物可根据其组成和性质进行分类。
(1)如图所示的物质分类方法是 。
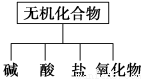
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面。
物质类别 | 酸 | 碱 | 盐 | 氧化物 |
化学式 | ①HCl ② | ③ ④Ba(OH)2 | ⑤Na2CO3 ⑥ | ⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的化学方程式: 。
(4)呼吸面具中用⑧作为O2来源的反应原理为: 。
(5)实验室制备⑦常用 和 反应,检验该气体的方法是 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习2-1物质的分类与转化 分散系练习卷(解析版) 题型:选择题
下列关于氧化物的叙述中正确的是 ( )。
A.酸性氧化物均可与可溶性碱起反应
B.酸性氧化物在常温下均为气态
C.不能跟酸反应的氧化物一定能跟碱反应
D.氧化物与水的反应都是化合反应
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版一轮复习1-2-1物质的量 气体摩尔体积练习卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列各项叙述中正确的有( )。
①0.2 mol H2O2完全分解转移的电子数为0.4NA
②25 ℃、101 kPa下,16 g O3和O2混合气体中含有的氧原子数为NA
③将含0.1 mol FeCl3的饱和溶液滴入沸水形成的胶体粒子的数目为0.1NA
④1 mol N2和3 mol H2在一定条件下的密闭容器中充分反应,容器内的分子数大于2NA
A.①②③ B.①②④ C.①②③④ D.②④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学考前题型专练 保温训练(三)(解析版) 题型:实验题
某研究性学习小组欲利用下列装置制取少量次氯酸钠,并进一步探究次氯酸钠的化学性质。
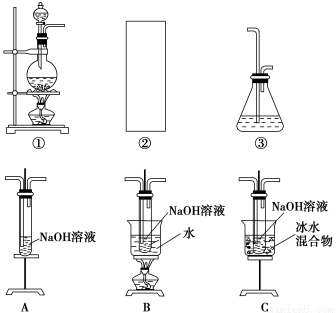
相关资料:反应Cl2+2NaOH=NaClO+NaCl+H2O属于放热反应,温度稍高时便发生副反应3Cl2+6NaOH=NaClO3+5NaCl+3H2O。
(1)制取氯气时,在烧瓶中加入一定量的二氧化锰,通过____________(填写仪器名称)向烧瓶中加入适量的浓盐酸。请在装置A、B、C中选择一个合适的装置放在②处:____________。
(2)部分学生认为上述装置存在缺点,他们指出在①②装置之间应增加如D所示的装置,你认为D中所盛液体是________,其作用是________________________________________。
(3)该小组对产品的性质进行了如下探究。
第一步,测其pH=10。结合相关离子方程式解释原因:_________________________________________________________________。
第二步,该小组的同学选用了紫色石蕊试液对次氯酸钠的性质进行探究。请你帮助他们完成下表:
实验操作 | 预期现象 | 结论 |
|
|
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com