
【题目】已知某溶液中含有Na+、Ba2+、Fe3+三种阳离子,那么溶液中的阴离子可能是( )
A. SO42- B. Cl- C. OH- D. CO32-
科目:高中化学 来源: 题型:
【题目】下列有关化学与生产、生活的说法中,不正确的是 ( )
A.陶瓷、水泥和玻璃都属于硅酸盐产品
B.低温下甲醇与水蒸气催化制氢,该反应属于氧化还原反应
C.铝合金的大量使用归功于人们能使用焦炭从氧化铝中获得铝
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】O2和O3是氧元素的两种单质,根据其分子式完成下列各题:
(1)等质量的O2和O3所含分子个数比为 , 原子个数比为 , 分子的物质的量之比为 .
(2)等温等压下,等体积的O2和O3所含分子个数比为 , 原子个数比为质量比为 .
(3)设NA为阿伏伽德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是(用含NA的式子表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示: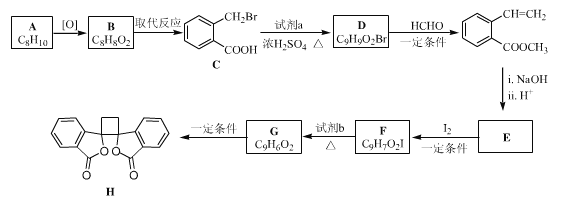
已知:
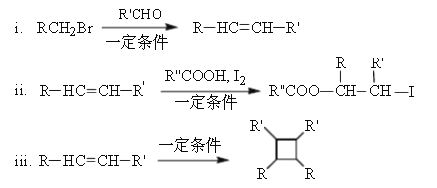
(以上R、R’、R’’代表氢、或烃基等)
(1)a属于芳香烃,名称是______________,B生成C的反应类型是__________。
(2)试剂a是(写结构简式)____________,HCHO的电子式是________________。
(3)E的结构简式是____________。
(4)由F生成G的化学方程式是 _________。
(5)二取代芳香化合物W是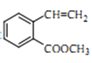 的同分异构体,能使溴的四氯化碳溶液褪色,能犮生银镜反应,能发生水解反应,W共有_______种(不含顺反异构和其他立体异构)。其中核磁共振氢谱为五组峰的结构简式为___________。
的同分异构体,能使溴的四氯化碳溶液褪色,能犮生银镜反应,能发生水解反应,W共有_______种(不含顺反异构和其他立体异构)。其中核磁共振氢谱为五组峰的结构简式为___________。
(6)以乙醇为起始原料,结合己知信息选用必要的无机试剂合成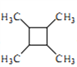 ,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。________________
,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语表示下列过程
(1)NaHSO4在熔融状态下的电离:___________。
(2)已知:C(s) + O2(g)![]() CO2(g) H1=a kJ/mol
CO2(g) H1=a kJ/mol
2CO(g) + O2(g)![]() 2CO2(g) H2=b kJ/mol
2CO2(g) H2=b kJ/mol
写出C(s) 和O2(g) 转化为CO(g) 的热化学方程式:______。
已知25 ℃时,两种弱酸的电离平衡常数HCN:Ka=4.9×10-10,H2CO3:Ka1=4.4×10-7,Ka2=4.7×10-11,向NaCN溶液中通入少量CO2反应的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示。B是红棕色固体,D是红棕色气体,E是常见的无色液体,G是淡黄色粉末。
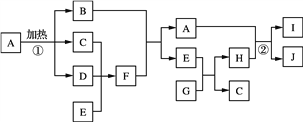
(1)F的化学式为__________。
(2)E的电子式为__________。
(3)写出E+G→H+C的化学方程式______________。
(4)写出反应②的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生活中有着重要的应用。下列叙述错误的是( )
A.燃煤中加入生石灰可以减少酸雨的形成
B.高纯度的二氧化硅广泛用于制作光导纤维
C.花生油中的主要成分属于酯类,是天然高分子化合物
D.碳纳米管表面积大,可用作新型储氢材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关“生物界和非生物界具有统一性”的说法正确的是
A. 具体表现为在无机自然界含有的元素在生物体内均可以找到
B. 具体表现为在细胞内各种元素的含量和无机自然界相同
C. 这种现象的表现之一是细胞中的氧元素的含量与非生物界中一样,都是含量最高的元素
D. 这种现象产生的原因与细胞膜的功能特点有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体的酸碱性对人类生产生活影响深远,某兴趣小组进行下列不同的研究:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表(H+与OH-未列出):
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为_______________,试样的PH值=______________。
(2)某温度下,有等体积、等pH值的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系为_______________;将等浓度、等体积的Al2(SO4)3溶液分别加入足量的上述三种碱溶液中,产生沉淀物质的量分别为n1、n2、n3,则三者的大小关系为________________。
(3)常温下,已知酸的电离平衡常数:HClO (K=3.0×10-8) H2CO3(K1=4.4×10-7 K2=4.7×10-11),请写出足量CO2通入NaClO溶液中的离子反应方程式:_____________。
(4)双氧水(H2O2)和水都是极弱电解质,但H2O2比水更显酸性。
①若把H2O2看成是二元弱酸,请写出它在水中的主要电离方程式:_________________。
②水电离生成H3O+ 和OH-叫做水的自偶电离。同水一样,H2O2也有极微弱的自偶电离,其自偶电离方程式为:____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com