
【题目】(1)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中![]() =_____________(保留三位有效数字);已知:Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
=_____________(保留三位有效数字);已知:Ksp(BaCO3)=2.6×109,Ksp(BaSO4)=1.1×1010。
(2)已知室温时,Ksp[Mg(OH)2]=4.0×1011。在0.1 mol/L的MgCl2溶液中,逐滴加入NaOH溶液,当Mg2+完全沉淀时,溶液的pH是_____________(已知lg2=0.3)。
 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中不正确的是
A. 在同温同压下,等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,溶液呈碱性
C. 氢氧化钡晶体与氯化铵晶体的反应属于吸热反应
D. 常温下,0.1 mol·L-1的NaOH溶液和0.06 mol·L-1的H2SO4溶液等体积混合,混合溶液的pH=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
(1)图中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母)。
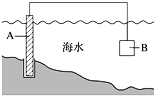
a.碳棒 b.锌板 c.铜板 d.钠块
(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
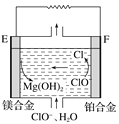
①E为该燃料电池的________(填“正”或“负”)极。F电极上的电极反应式为__________
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因_________。
③0.4molCuSO4和0.4molNaCl溶于水,配成1L溶液,用该镁燃料电池用惰性电极进行电解,当一个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积为_______L。
(3)如图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
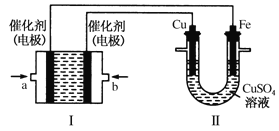
①b处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是_________________;
②电镀结束后,装置Ⅰ中溶液的pH_____________;(填写“变大”“变小”或“不变”)装置Ⅱ中Cu2+的物质的量浓度_______________;(填写“变大”“变小”或“不变”)
③在此过程中若完全反应,装置Ⅱ中阴极质量变化12.8g,则装置Ⅰ中理论上消耗甲烷________L(标况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热ΔH=-3677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法不正确的是()

A. 分子中每个原子最外层均达到8电子稳定结构
B. P4S3中硫元素为-2价,磷元素为+3价
C. 一个P4S3分子中含有三个非极性共价键
D. 热化学方程式为:P4S3(s)+8O2(g)=P4O10(s)+3SO2(g) ΔH=-3677 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2L密闭容器中投入一定量的A、B发生反应:3A(g) + bB (g) ![]() cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是
cC(g) ΔH=-Q kJ·mol-1(Q>0)。12s 时达到平衡,生成C的物质的量为0.8mol,反应过程如右图所示。下列说法正确的是

A.前12s内,A的平均反应速率为0.025mol·L-1·s-1
B.12s后,A的消耗速率等于B的生成速率
C.化学计量数之比b :c=1 :2
D.12s内,A和B反应放出的热量为0.2Q kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1932年美国化学家鲍林首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
元素 | H | Li | Be | B | C | N | O | F |
电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
元素 | Na | Mg | Al | Si | P | S | Cl | K |
电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
请仔细分析,回答下列有关问题:
(1)估计钙元素的电负性的取值范围:___________< X <___________;
(2)据表中的所给数据分析,同主族内的不同元素X的值变化的规律是_____________________________;
(3)某元素的电负性数值为1.8,请你预测其可能具有的性质(填“金属性、非金属性”等)__________________________________;
(4)据上表电负性数据,试推断AlBr3中形成的化学键的类型为______________,试用电子式表示其形成过程___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A是农药生产中的一种中间体,其结构简式如下图所示。下列叙述正确的是

A. 有机物A可与溴水发生加成反应
B. 1mol有机物A能消耗2molNaOH
C. 有机物A不能使酸性高锰酸钾溶液褪色
D. 有机物A分子中所有碳原子可能在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com