

| A. | 溶液中一定不存在CO32- | B. | 溶液中一定不存在Fe3+ | ||
| C. | 溶液中一定存在K+ | D. | 溶液中c(NO3-)=0.1mol/L |
分析 由实验可知,红褐色沉淀为氢氧化铁,则一定含Fe2+、Fe3+中的一种或两种,且n(Fe)=$\frac{3.21g}{107g/mol}$=0.03mol,则一定不含CO32-;与盐酸反应生成的气体为NO,NO被氧化生成红棕色的二氧化氮,由3Fe2++4H++NO3-=3Fe3++NO↑+2H2O可知,n(NO3-)=n(气体)=$\frac{0.224L}{22.4L/mol}$=0.01mol;与氯化钡反应生成白色沉淀为硫酸钡,则n(SO42-)=$\frac{9.32g}{233g/mol}$=0.04mol,然后结合电荷守恒可判断是否存在K+,以此来解答.
解答 解:由实验可知,红褐色沉淀为氢氧化铁,则一定含Fe2+、Fe3+中的一种或两种,且n(Fe)=$\frac{3.21g}{107g/mol}$=0.03mol,则一定不含CO32-;与盐酸反应生成的气体为NO,NO被氧化生成红棕色的二氧化氮,由3Fe2++4H++NO3-=3Fe3++NO↑+2H2O可知,n(NO3-)=n(气体)=$\frac{0.224L}{22.4L/mol}$=0.01mol;与氯化钡反应生成白色沉淀为硫酸钡,则n(SO42-)=$\frac{9.32g}{233g/mol}$=0.04mol,
A.由上述分析可知,一定不存在CO32-,故A正确;
B.阴离子电荷总数为0.04×2+0.01=0.09mol,n(Fe)=0.03,一定存在亚铁离子,不能确定是否含Fe3+,故B错误;
C.阴离子电荷总数为0.04×2+0.01=0.09mol,n(Fe)=0.03,一定存在亚铁离子,则含铁阳离子的阳离子电荷总数小,一定存在K+,故C正确;
D.溶液中c(NO3-)=$\frac{0.01mol}{0.1L}$=0.1mol/L,故D正确;
故选B.
点评 本题考查溶液成分的推断,为高频考点,涉及离子之间的反应、离子共存、电荷守恒等,侧重分析与推断能力的考查,注重学生思维严密性的训练,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH3CH2Br与NaOH溶液是否发生反应 | 将CH3CH2Br与NaOH溶液共热,冷却,取上层溶液,加AgNO3溶液,观察是否产生淡黄色沉淀 |
| B | 将打磨过的Al片投到一定浓度的CuCl2溶液,出现气泡并有固体生成,过滤,向固体中加入过量的氨水,固体部分溶解 | Al与CuCl2溶液反应,有H2和Cu(OH)2生成 |
| C | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变成红色 |
| D | 检验乙醇与浓硫酸共热是否产生乙烯 | 将乙醇与浓硫酸共热至170℃,所得气体通入酸性高锰酸钾溶液中,观察溶液是否褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
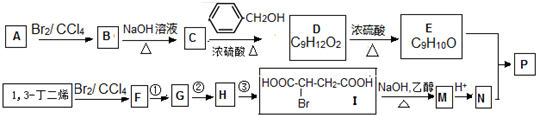
 ,
,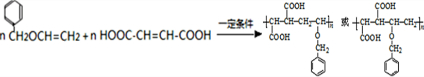 高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
高聚物P的亲水性比由E形成的聚合物强(填“强、弱”).
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
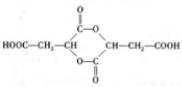 ;
;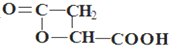 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜电极电解饱和氯化钠溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 过量铁与氯气反应:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 | |
| C. | 过氧化钠与水反应:2O22-+2H2O=4OH-+O2↑ | |
| D. | 向石灰水中滴加少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
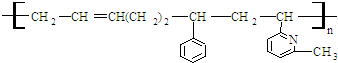
 ②CH2=CH
②CH2=CH ③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
③CH2=CH-CH═CH2④CH3-CH═CHH-CH2
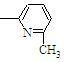 ⑥CH2=CH
⑥CH2=CH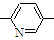 CH3
CH3| A. | ②③⑥ | B. | ②③⑤ | C. | ①②⑥ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4 LCO2含有的原子数为3NA | |
| B. | 0.1 mol Na2O2固体含有的阴、阳离子总数是0.3NA | |
| C. | 1.8gNH4+含有的质子数为NA | |
| D. | 标准状况下,2.24 L NO与1.12 L O2混合,所得气体中分子数为0.15NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com