
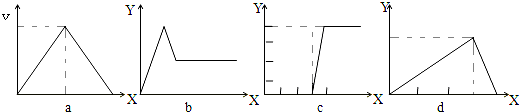
| A、①a | B、②b | C、③c | D、④d |
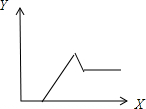 ;
;

 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
| A、依据气体的摩尔质量,推断相同状态下不同气体密度的大小 |
| B、依据物质相对分子质量,推断不同类晶体熔、沸点的高低 |
| C、依据元素的原子序数,推断该元素原子的核外电子数 |
| D、依据液体物质的沸点,推断将两种互溶液态混合物用蒸馏法分离的可行性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数是次外层电子数的2倍 |
| X | 元素最高正价+7价 |
| Y | 第三周期金属元素中原子半径最小 |
| Z | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
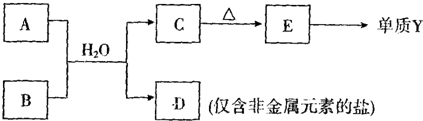
查看答案和解析>>
科目:高中化学 来源: 题型:
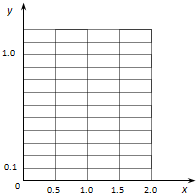
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
| B、糖尿病病人有糖分从尿液中排出,应多食用葡萄糖来补充 |
| C、营养物质并不是摄入越多越好,平时要注意膳食平衡 |
| D、高血压、高血脂的病人要尽量少食高脂肪食品 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、第IA族的元素都是金属元素 |
| B、L层电子数为奇数的所有主族元素,所在族的序数与元素原子的L层电子数相等 |
| C、主族元素的化合价绝对值与它的族序数一定相等 |
| D、同一主族元素的原子,最外层电子数相同,化学性质完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油分馏所得的馏分是一种具有固定熔沸点的纯净物 |
| B、石油裂化的主要目的是提高汽油等轻质油的产量 |
| C、石油裂解的原料是石油分馏产物,包括石油气 |
| D、石油在催化剂的作用下加热,可以使链状烃化为环状烃(如苯、甲苯) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com