
分析 (1)高锰酸钾有强氧化性,能氧化橡胶,滴定管精确到0.01,据此解题;
(2)只要能证明甲酸在水溶液部分电离就能说明甲酸是弱电解质,据此分析解答;
(3)锥形瓶中盛放氢氧化钠溶液,滴定管中盛放甲酸溶液,指示剂应该选用酚酞;刚好中和时溶质为甲酸钠;pH=7时c(Na+)+c(H+)=c(OH-)+c(HCOO-);
(4)根据c=$\frac{n}{V}$判断不当操作对n或V的影响判断.
解答 解:(1)A.量筒精确到0.1,故A错误;
B.滴定管精确到0.01,可用酸式滴定管,故B正确;
C.高锰酸钾有强氧化性,能氧化橡胶,应用酸式滴定管,故C错误;
D.烧杯只能粗略量取液体体积,故D错误.
故选B.
(2)A.0.01mol•L-1的HCOOH的pH为3,该溶液中氢离子浓度小于甲酸浓度,说明甲酸部分电离,为弱电解质,故A正确;
B.HCOONa溶液能使酚酞变红说明溶液呈碱性,显碱性的原因是盐中的甲酸根离子水解,证明甲酸是弱酸,故B正确;
C.强酸稀释至其体积的100倍时pH增加2,pH约为2.5说明为弱酸,故C正确;
D.导电性与离子浓度有关,不能说明部分电离,故D错误.
故选ABC;
(3)石蕊变色不明显,一般不用做中和滴定指示剂、甲基橙变色范围:3.1~4.4,锥形瓶中应该盛放氢氧化钠溶液,滴定管中盛放甲酸,二者恰好反应时溶液显示碱性,应该使用酚酞作为指示剂,刚好中和时溶质为甲酸钠,甲酸根水解生成甲酸和氢氧根,各离子的浓度按由大到小的排列顺序为:c(Na+)>c(HCOO-)>c(OH-)>c(H+);pH=7时c(Na+)+c(H+)=c(OH-)+c(HCOO-),氢离子与氢氧根相等,c(HCOO-)=c(Na+),
故答案为:酚酞;c(Na+)>c(HCOO-)>c(OH-)>c(H+);=;
(4)滴定到达终点时,仰视读出滴定管读数,会导致NaOH体积偏大,测定溶液浓度变大,故答案为:偏大.
点评 本题考查计量仪器及使用方法、强弱电解质的判断以及和中和滴定等,注意电解质强弱是根据其电离程度划分的,与其溶解性、酸碱性等都无关;注意滴定终点与反应终点尽量接近,题目难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
 X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
X、Y、Z、Q、E五种元素中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,Q的核电荷数是X与Z的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO、O2、NO2的分子数目之比为2:1:2 | |
| B. | 反应混合物中各组成物质的浓度相等 | |
| C. | 混合气体的颜色不再发生变化 | |
| D. | 生成2molNO同时生成1molO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应既能实现物质的转化、又能实现能量的转化 | |
| B. | 分子是保持物质化学性质的一种粒子 | |
| C. | 储存在物质中的化学能在化学反应前后是不变的 | |
| D. | 构成宏观物质的微观粒子之间的相互作用有多种形式,如离子键、共价键等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙烯都能被酸性KMnO4溶液氧化 | |
| B. | 煤的干馏和石油的分馏原理相同,都是化学变化 | |
| C. | 从苯的凯库勒式看,分子中含有双键,所以苯属于烯烃 | |
| D. | 乙醇分子中的化学键如图,在Cu等催化作用下和O2反应,①③处断裂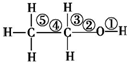 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4 | B. | CH2Cl2 | C. | NH3 | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制造太阳能电池的材料是单质硅 | |
| B. | 太阳能电池将光能转化为化学能 | |
| C. | 氢氧燃料电池中氢气在负极反应 | |
| D. | 碱性氢氧燃料电池中正极区有OH?生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com