
分析 ①加热,放出的气体可以使品红溶液褪色,证明其中含有H2SO3;
②取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝,证明含有NH4+;
③取原溶液加氯水,溶液略显黄色,说明含有Br-;再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,证明含有硫酸根,但是在亚硫酸存在的前提下,亚硫酸也会被氯水氧化为硫酸,所以不能确认SO42-在原溶液中是否存在.
综上可以看出,溶液中一定含H2SO3、NH4+、Br-,而SO42-的存在不能确定,以此解答该题.
解答 解:①加热,放出的气体可以使品红溶液褪色,证明其中含有H2SO3;
②取原溶液加碱,调至溶液呈碱性,加热,放出的气体能使湿润的红色石蕊试纸变蓝,证明含有NH4+;
③取原溶液加氯水,溶液略显黄色,说明含有Br-;再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸,证明含有硫酸根,但是在亚硫酸存在的前提下,亚硫酸也会被硝酸氧化为硫酸,所以不能确认SO42-在原溶液中是否存在.
综上可以看出,溶液中一定含H2SO3、NH4+、Br-,而SO42-的存在不能确定,
(1)溴水具有强氧化性,实验①加热时放出的气体也可以使溴水溶液褪色,说明该气体具有还原性,故答案为:还原;
(2)实验②加碱调至碱性后,加热时放出气体,该气体为氨气,发生反应的离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(3)亚硫酸也会被氯水氧化为硫酸,所以不能确认SO42-,原因是Cl2+H2SO3+H2O=2HCl+H2SO4,故答案为:Cl2+H2SO3+H2O=2HCl+H2SO4;
(4)检验硫酸根离子,可先加HCl酸化,无明显现象,再加BaCl2溶液,若有白色沉淀产生,则有SO42-,反之则无,
故答案为:先加HCl酸化,无明显现象,再加BaCl2溶液,若有白色沉淀产生,则有SO42-,反之则无.
点评 本题考查无机物的推断,侧重考查常见离子的检验方法,为高考常见题型和高频考点,题目难度中等,注意掌握常见离子的化学性质及检验方法,明确检验离子是否存在时,排除干扰离子,确保检验方案的严密性.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:实验题
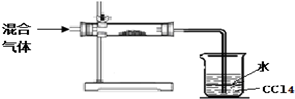
| 实验方案 | 可能的现象和相应的结论 |
| 取少量烧杯中的上层溶液分装入A、B两支试管中 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X-二氧化硫,Y-氢氧化钠溶液 | B. | X-氢氧化钠溶液,Y-硫酸铝溶液 | ||
| C. | X-二氧化碳,Y-偏铝酸钠溶液 | D. | X-二氧化碳,Y-饱和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 塑料、合成橡胶和合成纤维,都主要是以石油、煤、天然气为原料生产的 | |
| B. | 煤的综合利用包括煤作燃料、煤的干馏、煤的液化和气化 | |
| C. | 石油裂化的目的是使直链烃转化为芳香烃 | |
| D. | 包装用材料聚乙烯和聚氯乙烯都属于烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 和金属钠反应时断①键 | B. | 和乙酸反应时断②键 | ||
| C. | 在铜催化共热下与O2反应时断①③键 | D. | 在空气中完全燃烧时断①②③④⑤键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 难溶于水,易溶于乙醚 | |
| B. | 可与NaOH溶液发生水解反应 | |
| C. | 其同分异构体不可能有芳香族化合物 | |
| D. | 分子中含有的官能团是过氧键、醚键和酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
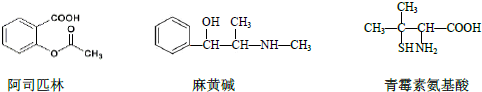
| A. | 三种有机物都能发生酯化反应 | |
| B. | 阿司匹林的苯环上的一氯代物有3 种 | |
| C. | 麻黄碱的分子式是C10H15NO,苯环上的一硝基取代物有3 种 | |
| D. | 青霉素氨基酸既能与盐酸反应,又能与NaOH 溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
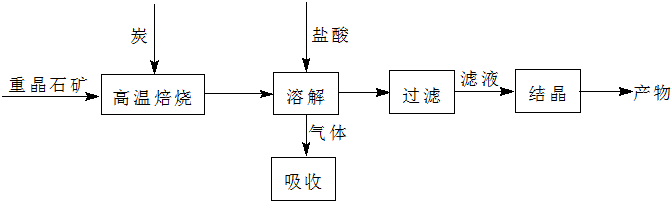
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com