
【题目】将一定质量的镁、铝合金投入100mL一定物质的量浓度HCl中,合金全部溶解,向所得的溶液中滴加5mol/L NaOH溶液到过量,生成沉淀的质量与加入的NaOH溶液体积关系如图。
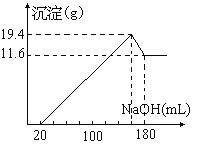
原合金中Mg质量_________,Al质量__________,盐酸的物质的量浓度______________。
【答案】4.8g 2.7g 8 mol/L
【解析】
由图可知,从开始至加入氢氧化钠溶液20mL,没有沉淀产生,说明原溶液中盐酸溶解镁、铝后有剩余,此时发生的反应为盐酸与氢氧化钠的中和反应,继续滴加氢氧化钠溶液,得到最大量沉淀为Mg(OH)2和Al(OH)3,二者质量为19.4g,再继续滴加氢氧化钠溶液,到沉淀不再溶解时,沉淀为Mg(OH)2,质量为11.6g,故Al(OH)3质量为7.8g,由元素守恒可知:n(Al)=n(Al(OH)3)=0.1mol,n(Mg)=n(Mg(OH)2)=0.2mol,m(Al)=2.7g,m(Mg)=4.8g;加入20mL氢氧化钠溶液恰好中和了盐酸,此时溶液的溶质为AlCl3、MgCl2、NaCl,根据钠元素守恒:n(NaCl)=n(NaOH)=0.02L×5mol/L=0.1mol,n(HCl)=3n(AlCl3)+2n(MgCl2)+n(NaCl)=0.8mol,c(HCl)=0.8mol÷0.1L=8 mol/L,故答案为:4.8g;2.7g;8 mol/L。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】不考虑羟基与氯原子在同一个碳原子上时,有机物C4H9ClO能与Na反应放出氢气的共有![]() 不考虑立体异构
不考虑立体异构![]() ( )
( )
A. 8种B. 9种C. 10种D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸具有抗氧化、延缓衰老、减肥降脂等功效,它的结构简式为:
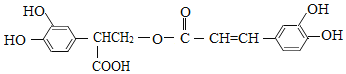
以邻苯二酚为原料合成迷迭香酸的路线为:
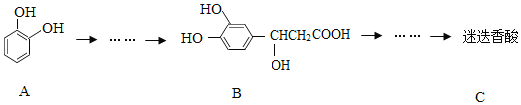
下列说法错误的是( )
A. 有机物B可以发生取代、加成、消去、氧化反应
B. 1 mol B与足量的NaOH溶液反应,最多可消耗4 mol NaOH
C. 迷迭香酸在稀硫酸催化下水解的一种产物可由B转化得到
D. 有机物A分子中所有原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B的产量可以用来衡量一个国家的石油化工发展水平。A、B、C、D、E之间能进行如图所示的反应。
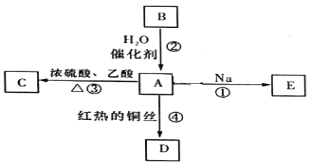
(1)A的官能团的名称________________,B的电子式为________________。
(2)写出①发生的化学反应方程式______________________。
(3)写出反应④的化学反应方程式______________________。
(4)下列关于化合物B的说法正确的是_____________(填字母)。
A.B分子中所有原子都在同一平面上
B.相同物质的量的B和甲烷完全燃烧消耗氧气的量相同
C.B可以与Cl2发生加成反应
D.B使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色的原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种香料,可采用乙烯与甲苯为主要原料,按下列路线合成:
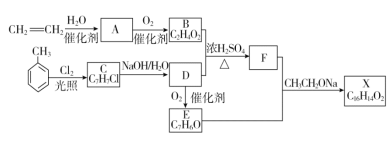
已知:RCHO+CH3COOR′![]() RCH=CHCOOR′。
RCH=CHCOOR′。
请回答:
(1)B中官能团的名称是_______
(2)C生成D的化学方程式:________ ,反应类型为________
(3)E和F生成X的化学方程式________
(4)对于化合物X,下列说法正确的是________
A.能发生水解反应 B.不与浓硝酸发生取代反应
C.能使Br2/CCl4溶液褪色 D.能发生银镜反应
(5)下列化合物中属于F的同分异构体的是________。
A. ![]()
B. ![]()
C.CH2=CHCH=CHCH=CHCH=CHCOOH
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验事实的离子方程式正确的是
A. 用醋酸检验牙膏中的摩擦剂碳酸钙:CaCO3+2H+=Ca2++H2O+CO2↑
B. 漂白粉溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3-
C. 酸性KI淀粉溶液久置后变蓝:4I-+O2+4H+=2I2+2H2O
D. Na2S溶液使酚酞试液变红:S2-+2H2O![]() 2OH-+H2S
2OH-+H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)有X、Y、Z三种短周期元素,原子半径大小关系为r(Y)>r(X)>r(Z),原子序数之和为16。X、Y、Z三种元素的常见单质分子在适当条件下可发生如图变化,其中B和C均为10电子分子.下列说法中不正确的是
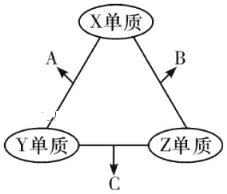
A. X与Z形成的某种化合物可用来杀菌消毒 B. C极易溶于B中,溶液呈碱性
C. Y与Z形成的二元化合物只含有极性键 D. A和C能发生氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为有机化合物,它们之间的关系如图所示
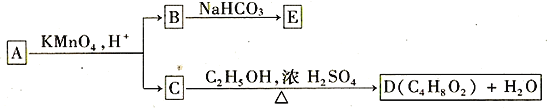
提示:①RCH=CHR'在酸性高锰酸钾溶液中反应生成RCOOH和R'COOH,其中R和R'为烷基。
②RCH2OH在酸性高锰酸钾溶液中反应生成RCOOH
③酸性:RCOOH > H2CO3
回答下列问题:
(1)直链化合物A的相对分子质量小于90,A分子中碳、氢元素的总质量分数为0.814,其余为氧元素,则A的分子式为__________________。
(2)已知B与NaHCO3溶液完全反应,其物质的量之比为1︰2,则在浓硫酸的催化下,B与足量的C2H5OH发生反应的化学方程式是_________________________________,反应类型为________________。
(3)A可以与金属钠作用放出氢气,能使溴的四氯化碳溶液褪色,则A的结构简式是______________。
(4)A还能发生多种化学反应,写出A发生下列反应的化学方程式并注明反应条件:
加聚反应:_________________________________________
消去反应:________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是重要的基础化工原料,可以制备亚硝酸(HNO2)、连二次硝酸(H2N2O2)、尿素[CO(NH2)2]等多种含氮的化工产品。
(1)水能发生自偶电离2H2O![]() H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
H3O++OH-,液氨比水更难电离,试写出液氨的自偶电离方程式_______。
(2)25℃时,亚硝酸和连二次硝酸的电离常数如下表所示:
化学式 | HNO2 | H2N2O2 |
电离常数 | Ka=5.1×10-4 | Ka1=6.17×10-8、Ka2=2.88×10-12 |
①物质的量浓度相同的NaNO2和NaHN2O2溶液的pH(NaNO2)_____pH(NaHN2O2)(填“>”、“<”或“=”)。
②25℃时NaHN2O2溶液中存在水解平衡,其水解常数Kh=_______(保留三位有效数字)。
③0.lmol/LNa2N2O2溶液中离子浓度由大到小的顺序为____________。
(3)以NH3与CO2为原料可以合成尿素[CO(NH2)2],涉及的化学反应如下:
反应I:2NH3(g)+CO2(g)![]() NH2CO2NH4(s) △H1=-159.5kJmol-1;
NH2CO2NH4(s) △H1=-159.5kJmol-1;
反应II:NH2CO2NH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
CO(NH2)2(s)+H2O(g) △H2=+116.5kJmol-1;
反应III:H2O(l)═H2O(g) △H3=+44.0kJmol-1。
则反应Ⅳ:NH3与CO2合成尿素同时生成液态水的热化学方程式为____________。
(4)T1℃时,向容积为2L的恒容密闭容器中充入n(NH3):n(CO2)=2:l的原料气,使之发生反应Ⅳ,反应结束后得到尿素的质量为30g,容器内的压强p随时间t的变化如图1所示。
①T1℃时,该反应的平衡常数K的值为___________。
②图2中能正确反应平衡常数K随温度变化关系的曲线为__________(填字母标号)。

(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图3所示。则b电极上的电极反应式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com