
 Fe(OH)3+3H+ (3分)
Fe(OH)3+3H+ (3分)  CH3COO-+H+。稀释促进电离,溶液中氢离子的物质的量增大,所以将某CH3COOH溶液稀释10倍,则稀释后的溶液中c(H+)大于原来的十分之一。
CH3COO-+H+。稀释促进电离,溶液中氢离子的物质的量增大,所以将某CH3COOH溶液稀释10倍,则稀释后的溶液中c(H+)大于原来的十分之一。 Fe(OH)3+3H+。
Fe(OH)3+3H+。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:不详 题型:填空题
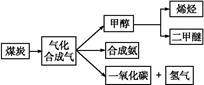
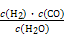 ,写出它所对应反应的化学方程式:
,写出它所对应反应的化学方程式:  CH3OH(g)
CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)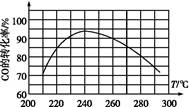
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。
(1)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料。试写出电解熔融氯化镁制取金属镁的化学反应方程式 。| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |

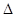 H=-570kJ/mol;
H=-570kJ/mol;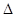 H=-242kJ/mol;
H=-242kJ/mol;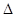 H=—110.5kJ/moL;
H=—110.5kJ/moL;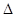 H=—393.5kJ/moL;
H=—393.5kJ/moL;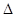 H=+890kJ/moL
H=+890kJ/moL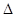 H=akJ/moL;则a= ;该反应的熵
H=akJ/moL;则a= ;该反应的熵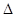 S 0(选填“>”、“=”、“<”);已知自由能
S 0(选填“>”、“=”、“<”);已知自由能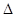 G=
G=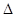 H—T
H—T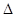 S,当
S,当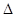 G<0时可自发进行。则该反应在什么条件下可自发进行__________________。
G<0时可自发进行。则该反应在什么条件下可自发进行__________________。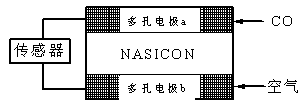
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) ΔH <0。
CH3OH(g) ΔH <0。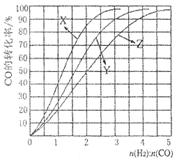
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-82kJ/mol | B.-41kJ/mol | C.-312kJ/mol | D.+82kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
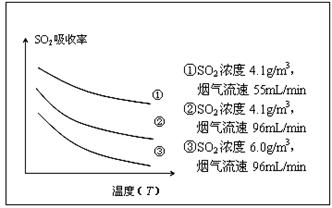
| 方法1 | 燃煤中加入石灰石,将SO2转化为CaSO3,再氧化为CaSO4 |
| 方法2 | 用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4 |
| 方法3 | 高温下用水煤气将SO2还原为S |
| 方法4 | 用Na2SO3溶液吸收SO2,再电解转化为H2SO4 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 SO3(g)+NO(g)
SO3(g)+NO(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1 SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。 SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。 CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
CH3OH(g)。今在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO(g)+H2(g),则该反应的平衡常数表达式为 。
CO(g)+H2(g),则该反应的平衡常数表达式为 。 2CO(g) △H1
2CO(g) △H1 H2(g)+CO2(g) △H2
H2(g)+CO2(g) △H2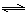 CO(g)+H2(g) △H3
CO(g)+H2(g) △H3 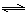 H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。
H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示。| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
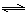 2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :
2NO2(g) △H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 :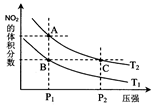
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

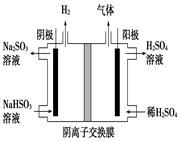
 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1 2NO2(g) ΔH="-113.0" kJ·mol
2NO2(g) ΔH="-113.0" kJ·mol SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH 0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com