
��һ�ݻ�������ܱ������г���һ����A��B���������·�Ӧ��
x A��g�� +2B��s�� y C��g��; ��H <0��һ�������£�������A��C�����ʵ���Ũ����ʱ��仯����������ͼ����ش��������⣺
y C��g��; ��H <0��һ�������£�������A��C�����ʵ���Ũ����ʱ��仯����������ͼ����ش��������⣺
��1����A��Ũ�ȱ仯��ʾ�÷�Ӧ0��10min�ڵ�ƽ����Ӧ����v��A��= ��
��2������ͼʾ��ȷ��x��y= ��
��3��0��l0min������ѹǿ____ �����������䡱��С����
��4���Ʋ��l0min�������߱仯�ķ�Ӧ���������� ����16min�������߱仯�ķ�Ӧ����������____ ��
�ټ�ѹ��������A��Ũ�ȣ�������C�����������£��ݽ��£��Ӵ���
��5����ƽ��I��ƽ�ⳣ��ΪK1��ƽ���ƽ�ⳣ��ΪK2����K1 K2���>����=����<����
��10�֣���1��0.02mol/(L��min)(2��) ��2��1��2��2�֣� ��3�����1�֣�
��4���ܢޣ�2�֣� �ܣ�1�֣� ��5��> (2��)
���������������1��v��A��=(0.45mol/L-0.25mol/L)��10min=0.02mol/(L��min)��
��2������ͼ����������ʷ�Ӧ�����ʵ���֮�ȵ��ڻ�ѧ������֮�ȵ�֪��x��y=1��2��
��3�����ݣ�2����֪������Ӧ�������������ģ���ѹǿ���
��4��l0min��ѧ��Ӧ���ʼӿ���ֱ�����ﻯѧƽ��״̬����Ӧ��������Ϊ���ºͼӴ�������ѡ�ܢޡ�16min���ǻ�ѧƽ�������ƶ����������Ӧ�Ƿ��ȷ�Ӧ���ʷ�Ӧ�������������£���ѡ�ܡ�
��5����ѧƽ�ⳣ���������������֮�����Է�Ӧ�����֮�������������K1>K2��
���㣺��Ӧ���� ƽ�ⳣ������ ƽ���ƶ�
���������⿼�鷴Ӧ���ʡ�ƽ�ⳣ�����㡢ƽ���ƶ��ȣ��Ѷ��еȣ�����ѧ���Ի���֪ʶ�����ճ̶ȡ�


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 4V |
| 3 |
| 4V |
| 3 |
| 4V |
| 3 |
| 4V |
| 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��537�桢1.01��105 Paʱ�����ݻ��ɱ���ܱ������г���1 mol X��3 mol Y����ʱ�ݻ�ΪV L�����ֺ��º�ѹ��������ӦX(g)+3Y(g)![]() 2Z(g)���ﵽƽ��ʱ��ƽ����������Z���������Ϊ0.5��
2Z(g)���ﵽƽ��ʱ��ƽ����������Z���������Ϊ0.5��
��1���ﵽƽ��ʱ��X��ת����ԼΪ ��
��2�����������¶Ⱥ�ѹǿ�㶨���䣬����������ֻ����4 mol Z����Ӧ�ﵽƽ��ʱ��ƽ��������Y ���������Ϊ ���������ݻ�Ϊ L��
��3������ѡһ�ݻ��̶�������ܱ��������Կ����¶Ȳ��䣬ʹ2 molX��6 mol Y��Ӧ���ﵽƽ��ʱƽ��������Z�����������Ϊ0.5������ܱ��������ݻ�Ϊ ��
��4�����¶���Ϊ537�棬�����������VL����(����)�������г���a mol X��b mol Y��ʹ��Ӧ�ﵽƽ�⣬��ʱƽ��������Z�����������Ϊ0.5����ϵѹǿΪ1.01��105 Pa����a: b = 1: 3����a = ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ���㽭ʡ��Ҧ��ѧ�߶���ѧ�����п���ʵ��ѧ�Ծ����������� ���ͣ������
(10��)����537�桢1.01��105Paʱ�����ݻ��ɱ���ܱ������г���1molX��3molY����ʱ�ݻ�ΪVL�����ֺ��º�ѹ��������ӦX(g)+ 3Y(g) 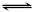 2Z(g)���ﵽƽ��ʱ��ƽ����������Z���������Ϊ0.5��
2Z(g)���ﵽƽ��ʱ��ƽ����������Z���������Ϊ0.5��
��1���ﵽƽ��ʱ��X��ת����ԼΪ ��
��2�����������¶Ⱥ�ѹǿ�㶨���䣬����������ֻ����4molZ����Ӧ�ﵽƽ��ʱ��ƽ��������Y���������Ϊ ���������ݻ�Ϊ L��
��3������ѡһ�ݻ��̶�������ܱ��������Կ����¶Ȳ��䣬ʹ2molX��6molY��Ӧ���ﵽƽ��ʱƽ��������Z�����������Ϊ0.5������ܱ��������ݻ�Ϊ
��4�����¶���Ϊ537�棬�����������VL���䣨���ݣ��������г���a mol X��b mol Y��ʹ��Ӧ�ﵽƽ�⣬��ʱƽ��������Z�����������Ϊ0.5����ϵѹǿΪ1.01��105Pa����a : b =" 1" : 3����a=
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ�ݻ�Ϊ5L�ĺ����ܱ������г���5molA��8molB����һ�����������·�Ӧ��2A(g)+3B (g)![]() xC(g)+yD(g) ��H<0��ʽ��x��yΪ������������Ӧ����2min��ﵽƽ�⣬����D�����ʵ���Ϊ1.5mol������2min��C��ƽ����Ӧ����v(C)=0.3mol/L��min����֪v(B)��v(C)=3��2��������˵���в���ȷ����
xC(g)+yD(g) ��H<0��ʽ��x��yΪ������������Ӧ����2min��ﵽƽ�⣬����D�����ʵ���Ϊ1.5mol������2min��C��ƽ����Ӧ����v(C)=0.3mol/L��min����֪v(B)��v(C)=3��2��������˵���в���ȷ����
A��ƽ����Ӧ���ʣ�v(A)=v(C) B�������������䣬���£������ܵ����ʵ�������
C��A��ƽ��Ũ��Ϊ0.4mol/L D��A��B��ƽ��Ũ��֮��Ϊ3��2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com