
【题目】如表所示有关物质检验的实验结论正确的是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
B | 向某溶液中加入盐酸,将生成的气体通入品红溶液中,品红溶液褪色 | 该溶液一定含有 |
C | 将SO2通入Na2CO3溶液中生成的气体,先通入足量的酸性KMnO4溶液,再通入澄清石灰水中有浑浊 | 说明酸性:H2SO3>H2CO3 |
D | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
A.AB.BC.CD.D
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】富马酸亚铁,是一种治疗缺铁性贫血的安全有效的铁制剂。富马酸在适当的pH条件下与FeSO4反应得富马酸亚铁。
已知:
物质名称 | 化学式 | 相对分子质量 | 电离常数(25℃) |
富马酸 | C4H4O4 | 116 | K1=9.5×10-4,K2=4.2×10-5 |
碳酸 | H2CO3 | K1=4.4×10-7,K2=4.7×10-11 | |
富马酸亚铁 | FeC4H2O4 | 170 |
i.制备富马酸亚铁:
①将富马酸置于100 mL烧杯A中,加热水搅拌
②加入Na2CO3溶液10 mL使溶液pH为6.5~6.7。并将上述溶液移至100 mL容器B中
③安装好回流装置C,加热至沸。然后通过恒压滴液漏斗D缓慢加入FeSO4溶液30 mL
④维持反应温度100℃,充分搅拌1.5小时。冷却,减压过滤,用水洗涤沉淀
⑤最后水浴干燥,得棕红(或棕)色粉末,记录产量。
请回答以下问题:
(1)该实验涉及到的主要仪器需从以下各项选择,则B为_________(填字母),C为___________(填名称);

(2)己知反应容器中反应物FeSO4和富马酸按恰好完全反应的比例进行起始投料,写出步骤②中加入Na2CO3溶液调节pH的目的是_____________,若加入Na2CO3溶液过量,对实验的影响是_____________;
(3)所需FeSO4溶液应现用现配,用FeSO4·7H2O固体配置FeSO4溶液的方法为:__________;
(4)写出容器B中制备富马酸亚铁的化学方程式:___________;
(5)步骤④检验沉淀是否洗净的方法是:________________;
ii. 计算产品的产率:
(6)经测定,产品中富马酸亚铁的纯度为76.5%、以5.80 g富马酸为原料反应制得产品8.50 g,则富马酸亚铁的产率为______________%(保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 氢原子的电子云图中小黑点的疏密表示电子在核外单位体积内出现机会的多少
B. 最外层电子数为ns2的元素都在元素周期表第2列
C. 处于最低能量的原子叫做基态原子,1s22s22![]() →1s22s22
→1s22s22![]() 过程中形成的是发射光谱
过程中形成的是发射光谱
D. 已知某元素+3价离子的电子排布式为1s22s22p63s23p63d5,该元素位于周期表中的第四周期第VIII族位置,属于ds区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,铁有δ、γ、α三种同素异形体,三种晶体在不同温度下能发生转化。下列说法不正确的是

A. δFe晶胞中含有2个铁原子,每个铁原子等距离且最近的铁原子有8个
B. 晶体的空间利用率:δFe > γFe> αFe
C. 设γFe晶胞中铁原子的半径为d,则γFe晶胞的体积是16![]() d 3
d 3
D. 已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1),δFe晶胞的密度为ρ g/cm3,则铁原子的半径r(cm)=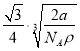
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,氯化钠、氯化铯、二氧化碳和二氧化硅的晶体结构分别如下图所示,下列关于这些晶体结构和性质的叙述不正确的是 ( )

A. 同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构
B. 氯化钠、氯化铯和二氧化碳的晶体都有立方的晶胞结构,它们具有相似的物理性质
C. 二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键
D. 在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分:
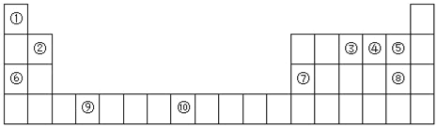
(1)表中属于s区的非金属元素是________(用元素符号表示),元素⑩核外电子排布式为________________,
(2)元素③④⑤电负性由小到大___________(用元素符号表示)
(3)若元素③用R表示,为什么可以形成RCl3分子,不可以形成RCl5分子:____________。
(4)元素⑤与⑧元素相比非金属性较强的是________(写元素名称),下列表述中能证明这一事实的是__________。
A.气态氢化物的挥发性和稳定性 B.两元素的电负性
C.单质分子中的键能 D.含氧酸的酸性
E.氢化物中X—H键的键长 F.两单质在自然界中的存在形式
(5)元素⑦的氧化物与元素⑧的最高价氧化物的水化物反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。
完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α |
(2)相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。
(3)碳酸:H2CO3,Ki1=4.3×10-7,Ki2=5.6×10-11
草酸:H2C2O4,Ki1=5.9×10-2,Ki2=6.4×10-5
0.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)
等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____。(选填编号)
a.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
c.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。
____________________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在平衡:Cr2O72-+H2O ![]() 2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
2CrO42-+2H+。K2Cr2O7为橙色,K 2CrO4为黄色。为探究浓度对化学平衡的影响,某兴趣小组设计了如下实验方案。
| 序号 | 试剂X |
ⅰ | 1 mL1mol·L-1 K2Cr2O7 溶液 | |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | |
ⅲ | 5~15滴浓硫酸 | |
ⅳ | 5~15滴浓盐酸 | |
ⅴ | 5~15滴6 mol·L-1 NaOH溶液 |
Ⅰ.方案讨论
(1)ⅰ~ⅴ中依据减少生成物浓度可导致平衡移动的原理设计的是______(填序号)。
(2)已知BaCrO4为黄色沉淀。某同学认为试剂X还可设计为Ba(NO3)2溶液,加入该试剂后,溶液颜色将_____。(填“变深”、“变浅”或“不变”)。
Ⅱ.实验分析
序号 | 试剂X | 预期现象 | 实际现象 |
ⅰ | 1 mL1 mol·L-1 K2Cr2O7 溶液 | 溶液变黄 | 溶液橙色加深 |
ⅱ | 1mL1 mol·L-1 K2CrO4溶液 | 溶液橙色加深 | 溶液颜色变浅 |
ⅲ | 5~15滴浓硫酸 | 溶液橙色加深 | 溶液橙色加深 |
ⅳ | 5~15滴浓盐酸 | 溶液橙色加深 | 无明显现象 |
ⅴ | 5~15滴6mol·L-1NaOH溶液 | 溶液变黄 | 溶液变黄 |
(1)实验ⅰ没有观察到预期现象的原因是____________,实验ⅱ的原因与其相似。
(2)通过实验ⅲ和ⅴ得出的结论为___________ 。
(3)实验ⅳ无明显现象,可能的原因是____________。
(4)某同学查阅资料发现:K2Cr2O7溶液与浓盐酸可发生氧化还原反应。但实验ⅳ中没有观察到明显现象,小组同学设计了两个实验,验证了该反应的发生。
① 方案一:取5 mL浓盐酸,向其中加入15滴0.1mol·L-1 K2Cr2O7溶液,一段时间后,溶液变为绿色(CrCl3水溶液呈绿色),有黄绿色气体生成。写出该变化的化学方程式__________。
② 请你设计方案二:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
实验步骤 | 实验结论 |
(1)A的质谱图如下: | (1)证明A的相对分子质量为:__________。 |
(2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 | (2)证明A的分子式为: ________________。 |
(3)另取两份9.0 g A分置于不同的试管中。往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 | (3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: | (4)A的结构简式为: __________________。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com