
 ;元素Z的离子结构示意图为
;元素Z的离子结构示意图为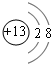 .
.分析 X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C,由于只有一种金属,故X为C元素,据此解答.
解答 解:X、Y、Z、W、R是短周期元素,原子序数依次增大,Y的氧化物和R的氧化物均能形成酸雨,则Y为N元素、R为S元素;W和R是同周期相邻元素,则W为P元素;Y原子和Z原子的核外电子数之和为20,则Z原子核外电子数=20-7=13,则Z为Al;X原子核外各层电子数之比为1:2,X有2个电子层,可能为Li或C,由于只有一种金属,故X为C元素.
(1)碳元素的最高价氧化物为CO2,分子中C原子与O原子之间形成2对共用电子对,其电子式为 ,元素Z为Al,铝离子核外有10个电子,有个电子层,各层电子数为2、8,离子结构示意图为
,元素Z为Al,铝离子核外有10个电子,有个电子层,各层电子数为2、8,离子结构示意图为 ,
,
故答案为: ;
; ;
;
(2)单质铜和稀硝酸反应生成硝酸铜、NO与水,反应的化学方程式为:8HNO3(稀)+3Cu═2NO↑+3Cu(NO3)2+4H2O,
故答案为:8HNO3(稀)+3Cu═2NO↑+3Cu(NO3)2+4H2O;
(3)元素W为P,最外层电子数为5,位于周期表的第VA族;P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱,故P的非金属性比元素S弱,
故答案为:VA;<;
(4)N和Al组成的化合物AlN,被大量用于制造电子元件.工业上用氧化铝、碳、氮气在高温下制备,其中氧化铝和碳的物质的量之比为1:3,说明还生成CO,则该反应的化学方程式为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO,
故答案为:Al2O3+3C+N2$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,侧重对化学用语的考查,(3)中注意理解同主族、同周期元素性质的相似性与递变性.


科目:高中化学 来源: 题型:选择题
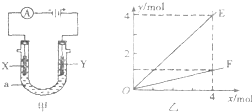 电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )
电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
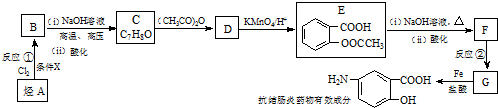
 $\stackrel{(CH_{3}CO)_{2}O}{→}$
$\stackrel{(CH_{3}CO)_{2}O}{→}$ (b)
(b) $→_{盐酸}^{Fe}$
$→_{盐酸}^{Fe}$
 ;
;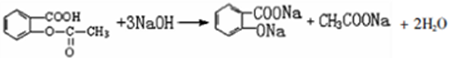 ;
; ;
; )易被氧化,苯环上连有烷基时再引入一个取代基,常取代
)易被氧化,苯环上连有烷基时再引入一个取代基,常取代 ) 合成路线中两种中间产物的结构简式(部分反应条
) 合成路线中两种中间产物的结构简式(部分反应条 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
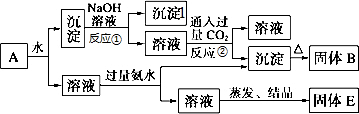
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
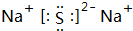 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 装置③中钢闸门应与外接电源的正极相连 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
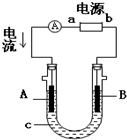 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏水 | B. | 0.5 mol/L的醋酸溶液 | ||
| C. | 0.5 mol/L的盐酸 | D. | 0.5 mol/L的氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈酸性 | B. | c(H+)=c(CH3COO-)+c(OH-) | ||
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | D. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com