
下列元素中,属于p区元素的是
A. H B. O C. Fe D. Mg
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。
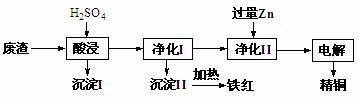
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式: 。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO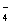 +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度= mol/L (只列出算式,不做运算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水的离子反应是4FeO42-+10H2O===4Fe(OH)3(胶体)+3O2↑+8OH-,工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O;
干法制备:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
下列有关说法中错误的是
A.高铁酸钾与水反应时,水发生氧化反应
B.干法中每生成1 mol Na2FeO4共转移4 mol电子
C.湿法中每生成1 mol Na2FeO4共转移3 mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有Fe3+、Fe2+、Al3+、 的稀溶液中加入足量Na2O2固体,充分作用后,再加入过量稀盐酸,完全反应,则离子数目没有变化的是
A.Fe3+、Al3+ B.Al3+ C.Fe2+、 D.Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
在Fe(OH)3胶体中,逐滴加入HI稀溶液,会出现一系列变化。
(1)先出现红色沉淀,原因是 。
(2)随后沉淀溶解,溶液呈黄色,此反应的离子方程式是 。
(3)最后溶液颜色加深,此反应的离子方程式是 。
(4)若用稀盐酸代替HI稀溶液,能出现上述哪些相同的变化现象(填写上面各题序号) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.K能层中不包含p能级 B.碳原子的电子排布式为1s22p4
C.3p3表示3p能级有三个轨道 D.同一原子中,2p、3p、4p能级的轨道数依次增加
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 ( )
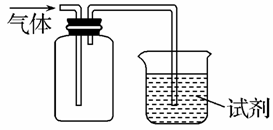
| 选项 | 试剂 | 现象 | 结 论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH 溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红色 后不褪色 | SO2有酸性,没 有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com