
【题目】设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,2.24 L水中含有分子数目为0.1NA
B.常温常压下,6.4 g氧气和臭氧中含有的原子总数为0.4NA
C.5.6 g铁与一定量硝酸恰好反应,转移的电子数目一定为0.3NA
D.常温下,2 L 0.1 mol·L-1Na2CO3溶液中,含有的CO32-离子数为0.2NA
科目:高中化学 来源: 题型:
【题目】FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是
A. 加入KSCN溶液一定不变红色 B. 剩余固体中一定含铜
C. 溶液中一定含Fe2+ D. 溶液中一定含Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在测定硫酸铜晶体结晶水含量的实验中,下列操作会引起测试结果偏小的是( )
A.加热前称量时坩埚未完全干燥
B.加热时间过长,晶体部分变黑
C.加热过程中有少量晶体溅出
D.在空气中冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.物质的量是一个基本物理量,表示物质所含粒子的多少
B.1 mol氢中含有2 mol氢原子和2 mol电子
C.1 mol H2O的质量等于NA个H2O分子质量的总和(NA表示阿伏加德罗常数)
D.摩尔表示物质的量的数量单位
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. NA个氧气分子与NA个氖气分子的质量比是4∶5
B. 17gOH-与19gH3O+所含质子数相等
C. 标准状况下,11.2LCO2与常温常压下8.5gNH3所含分子数相等
D. 12g C和16g O所含的原子数不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关NA(阿伏加德罗常数)说法错误的是( )
A.0.012 Kg 12C含有的12C是NA个
B.NA个水分子的质量是18 g/mol
C.1 mol O2中含有的氧分子数为NA个
D.含有NA个氧原子的H2SO4的物质的量是0.25 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究氯气的性质并用Cl2制备HClO,设计如下实验方案,请回答下列问题:
实验一:性质探究
设计图3实验装置来制备并验证氯气的性质,部分夹持设计未画出。
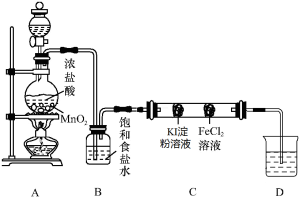
图3
(1)请写出装置A中制备氯气的反应化学方程式______________________;
(2)装置B的作用是______________________;
(3)双通管C中事先装有两个沾有相关试剂的棉球,实验现象为_____________;
实验二:制备HClO
(4)设计图4所示装置E代替图3中的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。


图4
①该方案反应后所得的溶液中HClO浓度比氯水中大的原因是_______________
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除CaCl2、HClO外,还含有__________
③该小组同学测得反应中碳酸钙质量减少a g,反应后从所得的100mL溶液中取用10mL与稀盐酸混合,连接F装置测得产生的气体体积为b L(已换算成标准状况),则原溶液中CaCl2的浓度为 mol·L-1(用含a、b的代数式表示,可不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三位同学按下列方法制取氢氧化铝,请你参与并回答有关问题。
甲:用可溶性铝盐与稀氨水反应制取氢氧化铝。写出该反应的离子方程式: 。
乙:根据右图电解装置制取氢氧化铝。请回答:

(1) 电源中A极是 极,铝极的电极反应式为 ;
(2)从原理分析,电解质NaCl的作用是 。
丙:利用铝屑、稀H2SO4、NaOH溶液为主要原料制取Al(OH)3固体。
(1)先设计了如下三种方案:
Ⅰ Al3+→Al(OH)3
Ⅱ Al→AlO2-→Al(OH)3
Ⅲ ![]()
从节省原料的角度分析,你认为最合理的方案是 。(填Ⅰ、Ⅱ或Ⅲ)
(2)设计了如下实验步骤:
①配制500 mL 0.5 molL-1NaOH溶液所用到的仪器有:托盘天平(含砝码)、烧杯、玻璃棒、 ;
②在烧杯A中加入50 mL 0.5 molL-1NaOH溶液,再加入足量铝屑给溶液稍加热。其作用是 ,用蒸馏水把铝屑冲洗,干燥后称其质量为m1 g(全部用于制氢氧化铝);
③在盛有适量稀H2SO4的烧杯B中放入 g(含m1的式子表示)铝屑,充分搅拌使铝屑反应完全;
④在盛有适量浓NaOH溶液的烧杯C中入一定质量的铝屑,充分搅拌使铝屑反应完全。该反应的化学方程式为 ;
⑤将烧杯B和烧杯C中的溶液混合,得到氢氧化铝白色沉淀;
⑥将沉淀过滤、洗涤、干燥得Al(OH)3固体m2 g。
试计算此实验中Al(OH)3的产率是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com