
(16分)氨、硝酸、硝酸铵、硝酸铜是重要的化工产品。工业合成氨与制备硝酸一般可连续生产,流程如下:

请回答下列问题:
(1)吸收塔中通入空气的作用是 。
下列可以代替硝酸镁加入到蒸馏塔中的是 。
A.浓硫酸 B.氯化钙 C.生石灰 D.硝酸亚铁
(2)制硝酸尾气中的氮氧化物常用尿素[CO(NH2)2]作为吸收剂,其主要的反应为:NO、NO2混合气与水反应生成亚硝酸,亚硝酸再与尿素[CO(NH2)2]反应生成CO2 和N2,请写出反应的化学方程式 、 。
(3)在氧化炉里,催化剂存在时氨气和氧气反应:
4NH3 + 5O2 4NO + 6H2O 4NH3 + 3O2
4NO + 6H2O 4NH3 + 3O2 2N2+ 6H2O
2N2+ 6H2O
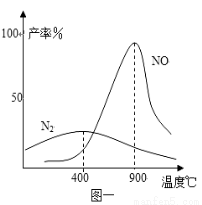
在不同温度时生成产物如图一所示。在氧化炉里,反应温度通常控制在800℃~900℃的理由是 。

(4)如图二所示装置可用于电解NO制备 NH4NO3,电解总反应方程式为 ,需补充氨气的理由是 。
(5)工业上通常用铜与浓硝酸反应制得光谱纯硝酸铜晶体(化学式为Cu(NO3)2·3H2O,摩尔质量为242g/mol)。已知:25℃、1.01×105 Pa时,在密闭容器发生反应:2NO2 N2O4,达到平衡时,c(NO2)=0.0400 mol/L,c(N2O4)=0.0100 mol/L。
N2O4,达到平衡时,c(NO2)=0.0400 mol/L,c(N2O4)=0.0100 mol/L。
现用一定量的Cu与足量的浓高纯度硝酸反应,制得5.00 L已达到平衡的N2O4和NO2的混合气体(25℃、1.01×105 Pa),理论上生成光谱纯硝酸铜晶体的质量为________ g。
(1)将NO、NO2等氧化为硝酸(2分) A (2分)
(2)NO+NO2+H2O=2HNO2 (2分) CO(NH2)2+2HNO2=CO2+2N2+3H2O (2分)
(3)800~900℃时副产物N2的产率较低,NO的产率很高。(或低于800℃副产物N2的产率较高,高于900℃时NO的产率反而很快降低) (2分)
(4)8NO+7H2O  3NH4NO3+2HNO3 (2分)将电解过程中生成的硝酸转化为硝酸铵(2分)
3NH4NO3+2HNO3 (2分)将电解过程中生成的硝酸转化为硝酸铵(2分)
(5) 36.3 (2分)
【解析】
试题分析:(1)氮气与氢气在合成塔内合成氨气,氨气在氧化炉中被氧化为NO、NO2;气体进入吸收塔内与水发生产生硝酸,若向吸收塔中通入空气,就可以使NO、NO2等氧化为硝酸;这样产生的硝酸浓度较小,一般是向硝酸溶液中加入硝酸镁,然后蒸馏就可以产生浓硝酸。若用其它物质代替硝酸镁,除了具有显酸性外,还应该不能与硝酸发生反应,不引入新的杂质,具有条件的只有浓硫酸,选项是A;(2)制硝酸尾气中的氮氧化物常用尿素[CO(NH2)2]作为吸收剂,其主要的反应为NO+NO2+H2O=2HNO2,CO(NH2)2+2HNO2=CO2+2N2+3H2O;(3)在氧化炉里,催化剂存在时氨气和氧气反应: 4NH3 + 5O2 4NO + 6H2O 4NH3 + 3O2
4NO + 6H2O 4NH3 + 3O2 2N2+ 6H2O。根据图像可知:在温度是200~600℃氧化产物主要是 N2,在在800℃~900℃氧化产物主要是 NO,副产物N2的产率较低;这样可以得到更多的产品;(4)根据图示可知NO被氧化为NO3-,被还原变为NH4+,氧化产物与还原错误二者结合形成NH4NO3,电解总反应方程式为8NO+7H2O
2N2+ 6H2O。根据图像可知:在温度是200~600℃氧化产物主要是 N2,在在800℃~900℃氧化产物主要是 NO,副产物N2的产率较低;这样可以得到更多的产品;(4)根据图示可知NO被氧化为NO3-,被还原变为NH4+,氧化产物与还原错误二者结合形成NH4NO3,电解总反应方程式为8NO+7H2O  3NH4NO3+2HNO3,在电解过程中需不断补充氨气是物理将电解过程中生成的硝酸转化为硝酸铵;(5)一定量的Cu与足量的浓高纯度硝酸反应,制得5.00 L已达到平衡的N2O4和NO2的混合气体(25℃、1.01×105 Pa),由于在25℃、1.01×105 Pa时,在密闭容器发生反应:2NO2
3NH4NO3+2HNO3,在电解过程中需不断补充氨气是物理将电解过程中生成的硝酸转化为硝酸铵;(5)一定量的Cu与足量的浓高纯度硝酸反应,制得5.00 L已达到平衡的N2O4和NO2的混合气体(25℃、1.01×105 Pa),由于在25℃、1.01×105 Pa时,在密闭容器发生反应:2NO2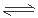 N2O4,达到平衡时,c(NO2)=0.0400 mol/L,c(N2O4)=0.0100 mol/L。则产生的气体的物质的量分别是:n(NO2)= 0.0400 mol/L×5.00 L=0.200mol;n(N2O4)= 0.0100 mol/L×5.00 L=0.0500 mol;反应过程中转移电子的物质的量是:n(e-)= n(NO2)+ 2×n(N2O4)=0.30 mol;消耗Cu产生Cu(NO3)2晶体的物质的量是0.30mol÷2=0.15mol。则纯硝酸铜晶体的质量为0.15mol×242g/mol= 36.3g。
N2O4,达到平衡时,c(NO2)=0.0400 mol/L,c(N2O4)=0.0100 mol/L。则产生的气体的物质的量分别是:n(NO2)= 0.0400 mol/L×5.00 L=0.200mol;n(N2O4)= 0.0100 mol/L×5.00 L=0.0500 mol;反应过程中转移电子的物质的量是:n(e-)= n(NO2)+ 2×n(N2O4)=0.30 mol;消耗Cu产生Cu(NO3)2晶体的物质的量是0.30mol÷2=0.15mol。则纯硝酸铜晶体的质量为0.15mol×242g/mol= 36.3g。
考点:考查反应条件的控制、化学操作的原因、化学方程式的书写、电解原理的应用、守恒方法在化学计算中的应用的知识。


科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是

A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三1月份阶段测试化学试卷(解析版) 题型:选择题
下列化学用语正确的是
A.HClO的电子式:
B.中子数为10的氧原子:
C.硝基苯的结构简式:
D.CH4分子的球棍模型:
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津南开区高三上学期第三次月考理综化学试卷(解析版) 题型:选择题
下列反应的离子方程式书写正确的是
A.往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2 = CaCO3↓+H2O
B.以石墨作电极电解氯化铝溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+ = 2Fe3++2H2O
D.少量硫酸氢钠溶液和氢氧化钡溶液混合:Ba2++SO42 -+2H++2OH-=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省攀枝花市高三上学期第二次统考理综化学试卷(解析版) 题型:选择题
25℃时,向20 mL 0.2 mol/L H2A(某二元弱酸)溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)?根据图示判断,下列说法中正确的是

A.当V(NaOH)=20mL时,所得溶液中:c(OH-)> c(H+)
B.当V(NaOH)=30mL时,所得溶液中:2c(H+) + c(HA-) + 3c(H2A) = c(A2-) + 2 c(OH-)
C.当V(NaOH)=40mL时,所得溶液中:c(Na+)> c(A2-) >c(H+)> c(HA-) >c(OH-)
D.在NaHA溶液中:c(OH-)+2c(A2-) = c(H+)+2c(H2A)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省达州市普高高三上学期第一次诊断理综化学试卷(解析版) 题型:填空题
(14分)碳及其化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)已知:①2CH4(g)+3O2(g) 2CO(g)+4H2O(l) △H1=-1214.6kJ/mol
2CO(g)+4H2O(l) △H1=-1214.6kJ/mol
②2CO(g)+ O2(g) 2CO2(g) △H2=-566kJ/mol,
2CO2(g) △H2=-566kJ/mol,
则甲烷与氧气反应生成二氧化碳和液态水的热化学方程式为 。
(2)已知在恒温恒压下密闭容器的可逆反应CH4(g)+ H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
①该可逆反应一定达到平衡的标志是 。
A.v(CH4)正=3v(H2)逆
B.水蒸气的浓度与一氧化碳的浓度相等
C.平均相对分子质量不随时间的变化而变化
D.密度不随时间的变化而变化
②该可逆反应在不同条件下,测得CH4转化率随时间变化如图所示,与实验a相比,b的实验条件是 。

(3)将不同物质的量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
CO(g)+H2O(g)  CO2(g)+H2(g);△H得到如下三组数据:
CO2(g)+H2(g);△H得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | CO2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | D | t |
①实验1中以v(H2)表示的反应速率为 。
②实验2中的平衡常数是 (计算结果保留两位小数)。
③该反应的△H 0(填“>”或“<”)。
④若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),则a、b应满足的关系
是 (用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市闸北区高三上学期期末化学试卷(解析版) 题型:选择题
铁、铜混合粉末18.0g加入到100ml 5.0mol/LFeCl3溶液中,剩余固体质量为3.2g。下列说法正确的是
A.剩余固体是铁、铜混合物
B.原固体混合物中铜的质量是9.6g
C.反应后溶液中n(Fe3+)=0.10 mol
D.反应后溶液中n(Fe2+)+ n(Cu2+)=0.75 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市普陀区高三一模化学试卷(解析版) 题型:选择题
不能用平衡移动原理解释的事实是
A.压缩盛有I2和H2混合气体的针筒,气体颜色变深
B.pH均为4的盐酸和NH4Cl(aq)中水的电离度后者大
C.打开汽水瓶盖,即有大量气泡逸出
D.用排饱和食盐水的方法收集氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com