
【题目】土壤胶粒带负电荷,因此土壤中施用含氮总量相同的下列化肥时,肥效最差的( )
A.(NH4)2SO4B.NH4HCO3C.NH4ClD.NH4NO3
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是(夹持装置未画出)

A. 用装置甲检验溶液中是否有K+
B. 用装置乙制取并收集少量NH3
C. 用装置丙进行喷泉实验
D. 用装置丁加热熔融NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要的意义。请回答下列问题:
(1)已知在25 ℃,101 kPa下,断开1 mol H—H键要吸收436 kJ的能量,断开1 mol I—I键要吸收151 kJ的能量,断开1 mol I—H键要吸收298 kJ的能量。
①通过以上数据计算当I2和 H2反应生成2 mol H—I时会放出9kJ的能量;若将1 mol I2和1 mol H2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25 ℃,101 kPa)远小于上述计算值,你认为最可能的原因是_______________________。
(2)一定条件下,甲烷与水蒸气发生反应:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
①一定温度下,向2L恒容密闭容器中充入1.6 mol CH4和2.4 mol H2O(g)发生上述反应,CO(g)的物质的量随时间的变化如图所示。0~2 min内的平均反应速率υ(H2)=__________ mol·L-1·min-1, 平衡时CH4的转化率为_____________。[转化率=![]() ×100%]
×100%]

②若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外, 还可以采取的措施有_______________________(任写一条)。
③下列能说明上述反应达到平衡状态的是________(填代号)。
a υ逆(CH4)=3υ正(H2)
b 恒温恒容时,容器内混合气体的密度保持不变
c CH4(g)、H2O(g)的浓度保持不变
d CH4(g)、H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1:3
e 断开3 mol H-H键的同时断开2 mol O-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载:“烧酒,其法用浓酒和糟入甑,蒸令气上,用器承滴露,”“凡酸坏之酒,皆可蒸烧”。这里用到的实验方法可以用于分离( )
A.植物油和食盐水B.丁醇和乙醚
C.硝酸钾和氯化钠D.碳酸钙和硫酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于二氧化硫的下列说法中,不正确的是( )
A.SO2是硫及其某些硫化物在空气中燃烧的产物
B.SO2具有漂白作用,也有防腐作用
C.SO2是硫酸的酸酐,称为硫酐
D.SO2是一种大气污染物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】性激素、胃蛋白酶、纤维素和DNA中都含有的元素是( )
A. C、H、O B. C、H、O、N
C. C、H、O、N、P D. C、H、O、N、P、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法正确的是

A. 该硫酸的物质的量浓度为 9.2 mol/L
B. 1 mol Zn与足量的该硫酸反应产生2 g氢气
C. 配制200 mL 4.6 mol/L的稀硫酸需取该硫酸50 mL
D. 该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】许多变化中存在着能量的变化,请回答下列问题:
(1)从化学键角度上看,化学反应的本质是____________。
已知反应2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
4NH3(g)+3O2(g),反应过程中的能量变化如图所示:
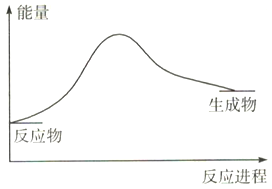
则反应中断裂的化学键是_______(用相应化学键的符号表示),该反应是_____(填“吸热”或“放热”)反应。4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
2N2(g)+6H2O(1)中,该反应中反应物的总能量____(填“>”或“<”)生成物的总能量。
(2)写出一个属于吸热反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式和结论之间的关系正确的是( )
A. 常温常压下,1g H2在足量Cl2中燃烧生成HCl放出92.3kJ的热量,则热化学方程式可表示为H2(g)+Cl2(g)=2HCl(g)△H= -184.6kJ
B. 甲烷的燃烧热为890.3kJ·mol-1则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3kJ·mol-1,则1molNaOH的稀溶液与足量的稀盐酸完全中和,其中和热为57.3kJ·mol-1
D. 500℃.30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H= -38.6kJ·mol-1
2NH3(g) △H= -38.6kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com