
若向溶有2.839 gx的溶液中加入过量的BaCl2溶液,可得到4.66 g沉淀,由此可推断x的化学式为( )
A.K2SO4·2Cr2(SO4)3 B.2K2SO4·Cr2(SO4)3
C.K2SO4·Cr2(SO4)3 D.K2SO4·0.5Cr2(SO4)3
科目:高中化学 来源:桂壮红皮书·高中同步系列·活题巧解巧练·高二化学(上) 题型:013
将两种硫酸盐按一定质量比混合后共熔得化合物W,已知W溶于水可电离出K+,Cr3+和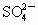 离子,现将2.83g W中的Cr3+离子全部氧化成
离子,现将2.83g W中的Cr3+离子全部氧化成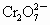 离子,再和过量KI溶液反应(
离子,再和过量KI溶液反应(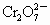 +6I-+14H+
+6I-+14H+ 2Cr3++3I2+7H2O)得到3.81g I2,另取2.83g W投入过量BaCl2溶液中,得到4.66g沉淀,由此判断W的化学式为:
2Cr3++3I2+7H2O)得到3.81g I2,另取2.83g W投入过量BaCl2溶液中,得到4.66g沉淀,由此判断W的化学式为:
①KCr(SO4)2 ②K2SO4·Cr2(SO4)3 ③K2SO4·Cr(SO4)2 ④K3Cr(SO4)3 ⑤KCr3(SO4)3
[ ]
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:013
A.K2Cr(SO4)3
B.K3Cr2(SO4)3
C.KCr3(SO4)3
D.KCr(SO4)2
查看答案和解析>>
科目:高中化学 来源:活题巧解巧练·高考化学(第一轮) 题型:013
将两种硫酸盐按一定质量比混合后制得化合物W,已知W溶于水可电离出K+,Cr3+和 ,现将2.83g W中的Cr3+全部氧化为
,现将2.83g W中的Cr3+全部氧化为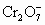 后,这些
后,这些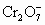 再和过量的KI溶液反应得到3.8g I2(
再和过量的KI溶液反应得到3.8g I2(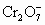 +6I-+14H+=2Cr3++3I2+7H2O);另取2.83g W投入过量的BaCl2溶液中,得到4.66g白色沉淀,由此判断W的化学式为
+6I-+14H+=2Cr3++3I2+7H2O);另取2.83g W投入过量的BaCl2溶液中,得到4.66g白色沉淀,由此判断W的化学式为
[ ]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com