
气体体积的大小,跟下列因素几乎无关的是
A.分子个数 B.温度 C.压强 D.分子直径
科目:高中化学 来源:2014-2015学年辽宁省五校协作体高一上学期期中化学试卷(解析版) 题型:填空题
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:

从实验可以判断,该固体粉末中(1)一定不含有 ,
(2)它的组成可能是 或 。
(3)加入盐酸后发生反应的离子方程式为 。
(4)要进一步确定其组成还应进行的实验操作是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列事实能说明醋酸是弱酸的是
① 醋酸钠溶液中CH3COO-与CH3COOH共存
② 0.1 mol/L的醋酸钠溶液的pH值约为9
③ 等体积、等浓度的硫酸和醋酸溶液与氢氧化钠反应,硫酸溶液消耗的氢氧化钠多
④ 0.1mol/L的醋酸的pH值约为4.8
⑤ pH值等于4、体积相等的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸液消耗碱液多
A.①②④⑤ B.②④ C.②③④ D.②③
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
下列萃取与分液结合进行的操作(用CCl4为萃取剂从碘水中萃取碘)中错误的是
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用左手压住分液漏斗上口部,右手握住活塞部分,把分液漏斗倒转过来振荡。
B.静置,分液漏斗中溶液分层,下层呈紫红色上层几乎无色。
C.打开分液漏斗的活塞使全部下层液体沿承接液体的烧杯内壁慢慢流出。
D.最后继续打开活塞另用容器承接并保存上层液体。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁沈阳铁路实验中学高一上学期第一次月考化学试卷(解析版) 题型:选择题
自来水中因含有少量Fe3+而不能用于溶液的配制,实验室为了除去自来水中的Fe3+获得纯净水,可采用的方法是
A.过滤法 B.结晶法 C.蒸馏法 D.沉淀法
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:填空题
(10分)现有25℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中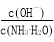 (增大、减小、不变)
(增大、减小、不变)
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
所得溶液的pH 7(填“>”“<”或“=”)。
(3)若向该氨水中加入氢氧化钠固体,则该电离平衡向 方向移动(分子化、离子化),电离平衡常数 。(增大、减小或不变)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高二上期中考试化学试卷(解析版) 题型:选择题
下列关于盐酸与醋酸两种稀溶液的说法正确的是
A.相同浓度的两溶液中c(H+)相同
B.100 mL 0.1 mol/L的两溶液能中和等物质的量的氢氧化钠
C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁大连市高一上期中考试化学试卷(解析版) 题型:填空题
(6分)已知:在水溶液或融化状态下能导电的化合物叫电解质。现有以下物质:①NaCl晶体②液态SO3③液态的醋酸④汞⑤BaSO4固体⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化的KNO3,请回答下列问题(填序号):
(1)以上物质中能导电的是
(2)以上物质中属于电解质的是
(3)以上物质中溶于水后形成的水溶液能导电的是
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省四地六校高二上学期第一次月考化学试卷(解析版) 题型:选择题
在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量Q kJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2 + 2NaOH = Na2CO3 + H2O,共消耗了4mol·L-1的NaOH溶液200 mL。则此条件下,下列热化学方程式正确的是 ( )
A.C4H10(g)+ O2(g)===4CO2(g)+5H2O(l) ΔH=-Q kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-Q kJ·mol-1
B.C4H10(g)+ O2(g)===4CO2(g)+5H2O(l) ΔH=-10Q kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=-10Q kJ·mol-1
C.C4H10(g)+ O2(g)===4CO2(g)+5H2O(l) ΔH=+ 10Q kJ·mol-1
O2(g)===4CO2(g)+5H2O(l) ΔH=+ 10Q kJ·mol-1
D.C4H10(g)+ O2(g)===4CO2(g)+5H2O(g) ΔH=-10Q kJ
O2(g)===4CO2(g)+5H2O(g) ΔH=-10Q kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com