

| A. | ②③ | B. | ④⑤ | C. | ①⑥ | D. | ①⑦ |
分析 配制一定物质的量浓度的溶液的步骤有:计算、称量、溶解、转移、洗涤、定容、摇匀等,据图示配制操作可知,步骤①使用托盘天平称量碳酸钠质量时,砝码与药品的位置颠倒了;步骤⑥中定容时仰视刻度线,该操作是错误的,正确应该平视刻度线.
解答 解:配制一定物质的量浓度的溶液步骤有:计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀等,
操作①中称量碳酸钠质量,药品与砝码位置颠倒,正确方法应该为“左物右码”,否则导致称量的碳酸钠质量偏小,故①错误;
操作②、③为溶解碳酸钠,使用玻璃棒搅拌,加速溶解过程,操作正确,故②③正确;
步骤④为转移冷却后的碳酸钠溶液,需要使用玻璃棒引流,玻璃棒下端放到容量瓶刻度线一下,过程中正确,故④正确;
步骤⑤为转移洗涤烧杯、和玻璃棒的溶液即直接加水定容,当加水到容量瓶刻度线1-2cm时停止,需要改用胶头滴管,该操作正确,故⑤正确;
操作⑥为使用胶头滴管定容,定容时眼睛应该与容量瓶刻度线平视,不能仰视刻度线,故⑥错误;
操作⑦为摇匀操作,摇匀时应该上下颠倒充分摇匀,故⑦正确;
所以以上错误操作有①⑥,
故选C.
点评 本题考查了配制一定物质的量浓度的溶液中的方法,该题是中等难度的试题,试题基础性强,贴近高考;该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力.


科目:高中化学 来源: 题型:选择题
| A. | 卤代烃的消去反应比水解反应更容易进行 | |
| B. | 在溴乙烷中加入过量NaOH溶液,充分振荡,然后加入几滴AgNO3溶液,出现黄色沉淀 | |
| C. | 消去反应是引入碳碳双键的唯一途径 | |
| D. | 在溴乙烷与NaCN、CH3C≡CNa的反应中,都是其中的有机基团取代溴原子的位置 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较这两种元素单质的硬度和熔点 | |
| B. | 在AlCl3和MgCl2溶液中分别滴加少量的NaOH溶液 | |
| C. | 将打磨过的镁带和铝片分别与热水作用,并向其中滴入酚酞溶液 | |
| D. | 将空气中放置已久的26Al、26Mg的单质分别与热水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )
某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器.他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置.通电数分钟后,果真制得了消毒液.他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是( )| A. | a为正极,b为负极;NaClO和NaCl | B. | a为负极,b为正极;NaClO和NaCl | ||
| C. | a为阳极,b为阴极;HClO和NaCl | D. | a为阴极,b为阳极;HClO和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.1 mol CO2通入足量NaOH溶液,则溶液中阴离子数目为0.1 NA | |
| B. | 标准状况下,将11.2 L的Cl2通入足量的NaOH溶液中,转移的电子数为NA | |
| C. | 0.1 mol N2与足量H2反应,转移的电子数为0.6 NA | |
| D. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
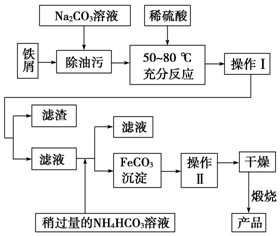 铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:
铁、铝和铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气体A是SO2和CO2的混合气体 | |
| B. | 固体A一定含有SiO2,可能含有BaSO4 | |
| C. | 该固体混合物中Fe2O3和Fe至少有其中一种 | |
| D. | 该固体混合物一定含有Fe、Na2SO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | 与Al同周期,金属性最强 |
| Y | 与Al同周期,最外层电子数是最内层电子数的3倍 |
| Z | 常温下单质为双原子分子,为黄绿色有毒气体 |
| W | 单质紫黑色,遇淀粉溶液显蓝色 |
 ;W在元素周期表中的位置是第五周期第ⅦA族;
;W在元素周期表中的位置是第五周期第ⅦA族;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com