
某学生设计了一个“黑笔写红字”的趣味实验.滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹.据此,下列叙述正确的是()

A. 铅笔端作阳极,发生还原反应
B. 铂片端作阴极,发生氧化反应
C. 铅笔端有少量的氯气产生
D. a点是负极,b点是正极
考点: 电解原理.
专题: 压轴题;电化学专题.
分析: 此为电解氯化钠溶液的实验装置,电解时的阴极反应为:2H++2e﹣═H2↑,或2H2O+2e﹣═H2↑+2OH﹣,阳极发生的反应为:2Cl﹣﹣2e﹣═Cl2↑,
总反应为:2NaCl+2H2O 2NaOH+Cl2↑+H2↑,阴极溶液呈碱性,滴加酚酞溶液呈红色,以此回答题中各项问题.
2NaOH+Cl2↑+H2↑,阴极溶液呈碱性,滴加酚酞溶液呈红色,以此回答题中各项问题.
解答: 解:A、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,反应为:2H++2e﹣═H2↑,或2H2O+2e﹣═H2↑+2OH﹣,溶液呈碱性,滴加酚酞溶液呈红色,故A错误;
B、阴极发生还原反应,阳极发生氧化反应,在该电解池中,铅笔做阴极,铂片做阳极,故B错误;
C、铅笔做阴极,反应为:2H++2e﹣═H2↑,或2H2O+2e﹣═H2↑+2OH﹣,有氢气产生,故C错误;
D、用铅笔在滤纸上写字,会出现红色字迹,说明铅笔做阴极,连接电源的负极,即a为负极,则b为正极,故D正确.
故选:D.
点评: 本题考查电解原理及应用,本题难度不大,做题时注意从反应的现象判断电解池的阴阳极入手来解答,注意把握电极反应和溶液离子浓度的变化.


科目:高中化学 来源: 题型:
25℃时,盐酸溶液的pH是4,氯化铵溶液的pH是5,盐酸与氯化铵溶液中水电离的c(H+)之比为()
A. 10:1 B. 1:10 C. 1:105 D. 105:1
查看答案和解析>>
科目:高中化学 来源: 题型:
在相同条件下,下列三个化学反应放出的热量分别以△H1、△H2、△H3表示:
(1)2H2(g)+O2(g)═2H2O(g)△H1
(2)2H2(g)+O2(g)═2H2O(l)△H2
(3)H2(g)+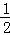 O2(g)═H2O(g)△H3
O2(g)═H2O(g)△H3
则△H1、△H2和△H3的关系是()
A. △H1=△H2=△H3 B. △H1<△H2,△H3=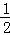 △H1
△H1
C. △H1>△H2,△H2=2△H3 D. 无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)△H=﹣47.2kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)△H=+640.5kJ/mol
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
以惰性电极电解CuSO4溶液.若阳极上产生气体的物质的量为0.0100mol,则阴极上析出Cu的质量为()
A. 0.64 g B. 1.28 g C. 2.56 g D. 5.12 g
查看答案和解析>>
科目:高中化学 来源: 题型:
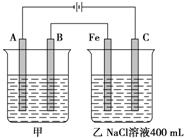
如图所示,甲、乙为相互串联的两电解池.
(1)甲池若为用电解原理精炼铜的装置,则A电极名称为阴极,电极材料是 ,电极反应式为 ,电解质溶液可以是 .
(2)乙池中Fe极电极反应式为 ,若在乙池中滴入少量酚酞试液,开始电解一段时间,Fe极附近呈 色.
查看答案和解析>>
科目:高中化学 来源: 题型:
取一定质量含Cu、Cu2O、CuO的固体混合物,将其分成两等份并进行下列转化,
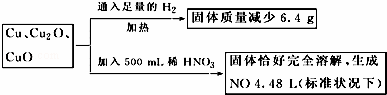
则转化过程中所加稀HNO3的物质的量浓度为( )
A.4.4 mol·L﹣1 B.3.6 mol·L﹣1
C.4.0 mol·L﹣1 D.3.2 mol·L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
I.将0.40mol N2O4气体充入2 L固定容积的密闭容器中发生如下反应:N2O4(g) 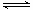 2NO2(g) △H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
2NO2(g) △H。在Tl℃和T2℃时,测得NO2的物质的量随时间变化如下图所示:
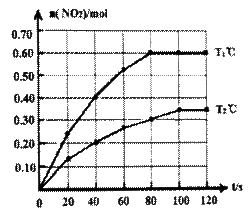
(1)Tl℃时,40s~80s内用N2O4表示该反应的平均反应速率为_________________mol/(L·s)。
(2)△H___________0(填“>”、“<”或“=”)。
(3)改变条件重新达到平衡时,要使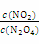 的比值变小,可采取的措施有__________(填序号)。
的比值变小,可采取的措施有__________(填序号)。
a.增大N2O4的起始浓度 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
II.已知:常温下,HCN的电离常数为Ka=5×10-10。
(4)有浓度相同的HCN和NaCN的混合溶液。
①通过计算说明该溶液的酸碱性_____________________________________________。
②该溶液中各离子的浓度由大到小的顺序是___________________________________。
(5)常温下,向某浓度的HCN溶液中逐滴加入NaOH溶液至溶液呈中性。
①该过程溶液中水的电离程度的变化为______________。
②若混合溶液中c(Na+)=a mol/L,则c(HCN)=_________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com