
【题目】用100mL2mol/L稀硫酸与过量铁片反应制取氢气时,下列措施能使氢气的生成的速率增大而产生氢气的量不变的是
A. 给反应体系适当加热 B. 向反应体系中加水稀释 C. 加入少量氧化铜固体 D. 加压
科目:高中化学 来源: 题型:
【题目】常温下,在pH=l的某溶液中可能含有Na+、Fe3+、Fe2+、CO32-、Cl-、I-中的某几种,现取100 mL该溶液进行如下实验:
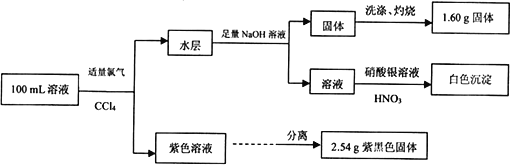
根据实验结果,下列有关原溶液的说法正确的是
A. 溶液中Fe2+与I-的物质的量浓度相等
B. 不能确定Na+和Cl-是否存在,CO32-一定不存在
C. 溶液中Fe3+与Fe2+至少有一种
D. 溶液中 c(Cl-)≥0.2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 甘油、植物油都可作溴水的萃取剂
B. 煤、石油可用作三大合成材料的原料
C. 棉花和羊毛的主要成分均属于高分子化合物
D. 蔗糖、麦芽糖可用新制的氢氧化铜悬浊液鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)性能优越,钛被称为“第三金属”(铁、铝分为第一、二金属),工业以TiO2冶炼Ti的主要反应有:①TiO2+2C+2Cl2![]() TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg![]() 2MgCl2+Ti下列叙述正确的是( )
2MgCl2+Ti下列叙述正确的是( )
A. 反应①是置换反应 B. 反应②是复分解反应
C. 反应①中TiO2是氧化剂 D. 反应②中金属镁是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷分子中的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述正确的是
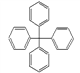
A. 此物质属于芳香烃,是苯的同系物
B. 所有碳原子可能在同一平面上
C. 常温下此分子为气态
D. 分子式为C25H20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能说明氯元素比硫元素非金属性强的是
①HC1比H2S稳定 ②HClO4酸性比H2SO4强 ③Cl2能与H2S反应生成s ④Cl2比S更易与H2化合生成相应气态氢化物 ⑤盐酸是强酸,而氢硫酸是弱酸
A. ①②③④⑤ B. ①②④⑤ C. ①②③④ D. ②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(13分)锰、铝、铁、钠的单质及其化合物在工业生产中有着广泛应用。请回答下列问题:
(1)工业上可用铝与软锰矿(主要成分为MnO2)反应来冶炼锰。
①用铝与软锰矿冶炼锰的原理是(用化学方程式来表示) 。
②MnO2在H2O2分解反应中作催化剂。若将适量MnO2加入酸化的H2O2的溶液中,MnO2溶解产生Mn2+,该反应的离子方程式是 。
(2)将一定量的铁粉在氯气中燃烧后所得固体溶于水可得到溶液X。取少量X溶液两份,一份加入KSCN 溶液时,溶液显红色;另一份中加入黄色铁氰化钾 (K3[Fe(CN)6])溶液后能发生复分解反应生成蓝色沉淀。已知:K3[Fe(CN) 6]的电离方程式为K3[Fe(CN)6]= 3K++[Fe(CN) 6]3-。请分析:
①用化学方程式表示产生两种金属阳离子的原因 。
②蓝色沉淀是由铁氰化钾与低价态阳离子反应的结果,试写出该反应的离子方程式 。
(3)将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化。
请完成下列问题:
①反应过程中共得到的气体的体积为 (标准状况);
②最终是否有沉淀产生? (填“是”或“否”),若有沉淀产生,其质量为 。 (若不存在,则不必回答第(2)问)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com