
| A. | 一定温度下,10mL 0.50mol•L-1NH4Cl溶液与20mL 0.25mol•L-1NH4C1溶液含NH4+物质的量相同 | |
| B. | 25℃时,将a mo1•L-l氨水与0.01 moI•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定温度下,已知0.1 mol•L-1 的醋酸溶液中存在电离平衡:CH3COOH?CH3COO-+H+,加少量烧碱溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB |
分析 A、铵根离子水溶液中水解,浓度不同水解程度不同分析;
B、当溶液中c(NH4+)=c(C1-),说明溶液呈中性,有c(H+)=c(OH-)=10-7,NH3•H2O的电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$;
C、要使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大,应是平衡向电离的方向移动,结合影响平衡移动的因素解答该题;
D、等体积等PH值的酸,酸的浓度越大,酸性越弱.
解答 解:A、NH4Cl 浓度越小,NH4+水解程度越大,不考虑水解1L 0.50mol•L-1NH4Cl 溶液与2L 0.25mol•L-1 NH4Cl 溶液铵根的物质的量相同,但0.25mol•L-1NH4Cl 溶液中铵根水解程度大,所以含NH4+ 物质的量前者大,故A错误;
B、当溶液中c(NH4+)=c(C1-),说明溶液呈中性,有c(H+)=c(OH-)=10-7,故NH3•H2O的电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.005×1{0}^{-7}}{0.5(a-0.01)}$=$\frac{1{0}^{-9}}{a-0.01}$,故B正确;
C、加入少量烧碱溶液,反应生成CH3COO-,c(H+)减小,由于CH3COO-对CH3COOH的电离起到抑制作用,则$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值减小,故C错误;
D、当体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明HA的物质的量大于HB的物质的量,溶液的体积相等,HA的物质的量浓度大于HB的,所以说明酸性:HA<HB,故D错误;
故选B.
点评 本题考查了盐类水解程度大小的影响因素、电离平衡常数的计算、弱酸的电离平衡移动、pH相等的酸,酸性越弱其浓度越大,题目难度不大.


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | pH=13 | |
| B. | pH=2 | |
| C. | 由水电离出的c(H+)=0.01 mol/L | |
| D. | 溶质的物质的量浓度为0.005 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 着色剂---胡萝卜素、苯甲酸钠 | B. | 调味剂---亚硝酸钠、味精 | ||
| C. | 防腐剂---氯化钠、柠檬黄 | D. | 营养强化剂---酱油中加铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
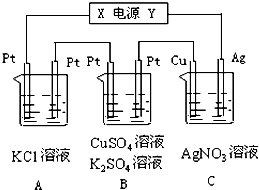 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳和甲烷均是造成温室效应的气体 | |
| B. | 可借助于核磁共振氢谱区分乙醇和二甲醚这两种物质 | |
| C. | 漂白液的有效成分是NaClO,制作计算机芯片的材料是SiO2晶体 | |
| D. | 食醋可去除水垢,NH4Cl溶液可去除铁锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属元素间形成的化学键都是共价键 | |
| B. | 第三周期主族元素的最高正化合价等于它所处的族序数 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 最外层电子数相同的原子属于同一族且化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阴极:NaOH溶液质量分数 | 阳极:NaCl溶液浓度(g/L) | |
| 进料液 | 0.30 | 310 |
| 电解后 | 0.32 | 210 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com