
【题目】下列叙述中正确的是( )
A.最外层有2个电子的原子都是金属原子
B.除短周期外,其他周期均有18个元素
C.副族元素中没有非金属元素
D.碱金属元素是指IA族的所有元素
科目:高中化学 来源: 题型:
【题目】国家规定,酿造食醋的总酸含量标准为3.5~5.0g/100mL(总酸含量即100mL食醋中CH3COOH的质量)。某化学兴趣小组为测定某市售食醋的总酸含量,进行了实验.实验后,得知10.0mL该食醋样品与7.5g溶质的质量分数为4%的氢氧化钠溶液恰好完全反应.计算该市售食醋样品中的总酸含量,并说明是否符合国家标准(假设该市售食醋样品中其他物质不与氢氧化钠发生反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将镁铝的固体混合物0.1mol溶于100mL 2mol·L-1稀硫酸中充分反应后,固体全部溶解,然后再向反应后的混合溶液中滴加2mol·L-1NaOH溶液。
(1)若在滴加NaOH溶液过程中,使Mg2+、Al3+全部生成沉淀,则滴入的NaOH溶液体积是 mL。
(2)设0.1mol镁铝固体混合物中Mg的物质的量分数为a,若在滴加NaOH溶液230mL后,所得沉淀只有Mg(OH)2,则a的取值范围 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)将CO2转化为甲醇可以有效利用资源,同时又可控制温室气体,原理为:CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
由下图所示的能量变化,写出将CO2转化为甲醇的热化学方程式:
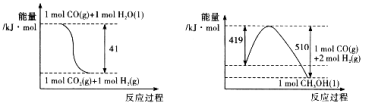
Ⅱ.回收铅蓄电池的电极填充物(铅膏,主要含PbO、PbO2、PbSO4),可制备热稳定剂三盐基硫酸铅(组成可表示为3PbO·PbSO4·H2O),其实验流程如下:

(2)物质X可以循环利用,该物质是。最后一次过滤之后需要洗涤,检验三盐基硫酸铅是否洗净的方法是 ;
(3)流程中不直接利用H2SO4溶液与PbO、PbCO3反应制取PbSO4,原因可能是:____________;
(4)生成三盐基硫酸铅的离子反应方程式为 ;
(5)向铅膏浆液中加入Na2SO3溶液的目的是将其中的PbO2还原为PbO。若实验中所取铅膏的质量为47.8g,其中PbO2的质量分数为15.0%,则要将PbO2全部还原,至少需加____ mL1.0mol/LNa2SO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)最近有人利用反应“2C4H10+13O2=8CO2+10H2O”制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
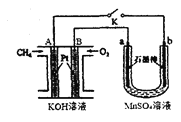
固体电解质中的O2-向 极移动(填“正”或“负”);写出该燃料电池的电极反应式:电池正极 ;电池负极 。
(2)用如图装置电解MnSO4溶液制MnO2时,A极为: 极, A电极电极反应式为 ;a极为: 极,电解MnSO4溶液制MnO2的化学方程式 。电解一段时间后, 溶液的pH将 (填“增大”、“减小”或“不变”)。
(3)精炼铜时,粗铜应与直流电源的____________极(填“正”或“负”)相连,阴极的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置进行实验,有关现象和解释均正确的是
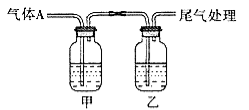
选项 | 足量A | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
A | CO2 | Na2SiO3溶液 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
B | Cl2 | 紫色石蕊 | Fe(SCN)3 | 开始均变红 | Cl2溶于水显酸性 |
C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
D | NH3 | AgNO3溶液 | AlCl3 | 现象相同 | NH3·H2O电离出OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
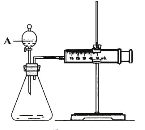
【题目】用如下图所示的装置来测定镁与硫酸反应的速率,在锥形瓶中加入0.7克镁带,按右图连接好装置,从A中加入20.0ml0.5mol/LH2SO4。记录注射器活塞的位置和相应的时间。记录数据如下
时间/s | 0 | t | 2t | ...... |
活塞的位置/ml | 17.3 | 25.6 | 36.6 | ...... |
(1)检查该装置气密性的方法是。
(2)仪器A的名称是。
(3)0-t时间段与t-2t时间段,化学反应速率最快的是,原因是。
(4)用上述装置探究Fe3+、Cu2+对双氧水分解速率的影响,所用试剂:5%H2O2、0.1mol/LFeCl3、0.2mol/LCuCl2,完成下表的实验设计:
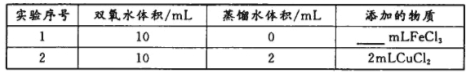
①写出本实验H2O2分解反应方程式并标明电子转移的方向和数目:___________。
②上表中需要添加的物质是mlFeCl3溶液。
③本实验需要测定的数据是。
(5)为确定MnO2催化双氧水分解的最佳条件,用该实验装置进行实验,反应物用量和反应停止的时间数据如下表。
MnO2 时间 H2O2 | 0.1g | 0.3g | 0.8g |
10mL1.5% | 223s | 67s | 36s |
10mL3.0% | 308s | 109s | 98s |
10mL4.5% | 395s | 149s | 116s |
分析表中数据回答下列问题:
①相同浓度的过氧化氢的分解速率随着MnO2用量的增加而_______(填“加快”、“减慢”或“不变”)。
②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入__________g的MnO2为较佳选择。
③该小组的某同学分析上述数据后认为:“当用相同质量的MnO2时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确?______(填“正确”或“不正确”),理由是_________________________。(提示:H2O2溶液的密度可认为近似相等。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ⅰ容器恒压,Ⅱ容器恒容,其它条件相同时,在Ⅰ、Ⅱ中分别加入3molZ,起始时容积相同,发生反应2X(g)+2Y(s)![]() 3Z(g)并达平衡。下列说法正确的是
3Z(g)并达平衡。下列说法正确的是
A.从起始到平衡所需时间:Ⅰ>Ⅱ
B.平衡时Z的转化率:Ⅰ<Ⅱ
C.平衡后若在Ⅰ中再加入0.1molY,则X的物质的量将减少
D.平衡后若在Ⅱ中再加入2molZ,则新平衡时Z的体积分数变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com