
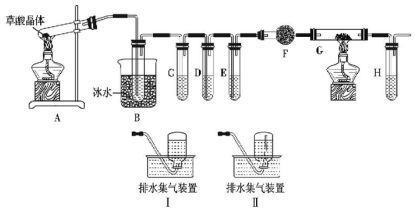
分析 检验草酸晶体的分解产物中含有CO、CO2.草酸晶体170℃以上分解,A装置:草酸晶体受热分解,草酸晶体熔点为101℃,如果草酸受热分解,分解时会产生二氧化碳而使澄清石灰水变浑浊;草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,B装置:有冷凝作用,防止干扰实验;C装置:用澄清石灰水检验二氧化碳,D装置:用浓氢氧化钠除去二氧化碳,E装置:用澄清石灰水检验二氧化碳是否除尽,F装置:用碱石灰干燥CO,G装置:利用CuO的氧化性将CO氧化,H装置:再利用澄清石灰水检验生成的二氧化碳,用排水法收集CO.
(1)草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,B装置温度较低,有冷凝作用,防止干扰实验;
(2)装置C中二氧化碳和氢氧化钙反应生成难溶性的碳酸钙沉淀而使澄清石灰水变浑浊,据此书写离子方程式;
(3)草酸晶体分解时有CO2气体生成,因此探究分解过程中有无CO生成时,首先要排除CO2的干扰,再利用CO的还原性来及氧化产物来验证,装置D吸收CO2气体,防止干扰CO气体的检验;
(4)F装置:用碱石灰或无水氯化钙干燥CO;
(5)CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,利用CuO的氧化性将CO氧化,再利用澄清石灰水检验生成的二氧化碳,通过检验二氧化碳检验一氧化碳的存在,草酸晶体分解时有CO2气体生成,需排除二氧化碳的干扰;
(6)Ⅰ、Ⅱ排水法收集的区别为Ⅰ是导管伸入到集气瓶底部,Ⅱ是导管伸入到集气瓶口;
(7)H2C2O4与KMnO4酸性溶液发生氧化还原反应,草酸被氧化生成二氧化碳和水,高锰酸钾被还原为锰离子;根据化学方程式2MnO2-+5H2C2O4 +6H+═2Mn2++10CO2↑+8H2O 及各物质之间的关系H2C2O4•xH2O~H2C2O4 ~xH2O进行计算;
(8)依据以上实验,草酸晶体的受热分解生成CO、CO2、水,据此书写方程式.
解答 解:(1)草酸晶体170℃以上分解,A装置:草酸晶体受热分解,草酸晶体熔点为101℃,如果草酸受热分解,分解时会产生二氧化碳而使澄清石灰水变浑浊;草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水,草酸易挥发,导致生成的气体中含有草酸,草酸和氢氧化钙反应生成难溶性的草酸钙而干扰二氧化碳的检验,B装置:有冷凝作用,防止干扰二氧化碳的检验,
故答案为:冷凝草酸气体,防止草酸进入装置C反应生成沉淀而干扰CO2的检验;
(2)装置C中氢氧化钙和二氧化碳反应生成碳酸钙和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O,离子方程式为:Ca2++2OH-+CO2=CaCO3↓+H2O;
故答案为:Ca2++2OH-+CO2=CaCO3↓+H2O;
(3)CO具有还原性,其氧化产物是二氧化碳,二氧化碳能使澄清石灰水变浑浊,G装置:利用CuO的氧化性将CO氧化,H装置:再利用澄清石灰水检验生成的二氧化碳,通过检验二氧化碳检验一氧化碳的存在,所以C装置:用澄清石灰水检验二氧化碳,D装置:用浓氢氧化钠除去二氧化碳,E装置:用澄清石灰水检验二氧化碳是否除尽,防止干扰CO气体的检验,
故答案为:吸收CO2气体,防止干扰CO气体的检验;
(4)F装置仪器为球形干燥管,干燥CO可选择碱石灰或无水氯化钙,
故答案为:碱石灰或无水氯化钙;
(5)若反应产物中有CO,通过排除CO2的干扰后,经过上述实验操作可观察到通G前的E装置不变浑浊证明无CO2,G中黑色粉末变为红色证明有还原性气体,G后面的H装置中澄清石灰水变浑浊证明有CO2生成,
故答案为:G中黑色粉末变为红色,其后的H中澄清石灰水变浑浊;
(6)Ⅰ、Ⅱ排水法收集的区别为Ⅰ是导管伸入到集气瓶底部,收集的气体不纯,Ⅱ是导管伸入到集气瓶口,收集的气体纯净,所以选择I,
故答案为:Ⅰ;
(7)H2C2O4与KMnO4酸性溶液发生氧化还原反应,草酸被氧化生成二氧化碳和水,高锰酸钾被还原为锰离子,化学方程式:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O,
25.0mL待测溶液中由5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
5mol 2mol
n 0.4mol/L×12.50mL
解得:n=1.25×10-2mol,100.0mL水溶液n(H2C2O4)=5×10-2mol,6.3g草酸晶体中草酸的质量为5×10-2mol×90g/mol=4.5g,结晶水的质量为6.3g-4.5g=1.8g,n(H2O)=0.1mol,H2C2O4•xH2O~H2C2O4 ~xH2O n(H2C2O4):n(H2O)=5×10-2mol:0.1mol=1:x,解得x=2,
故答案为:5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O;2;
(8)依据以上实验,草酸晶体的受热分解生成CO、CO2、水,方程式为:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O,
故答案为:H2C2O4•2H2O$\frac{\underline{\;\;△\;\;}}{\;}$CO↑+CO2↑+3H2O.
点评 本题考查草酸晶体分解以及产物性质实验,为高频考点,侧重考查学生知识综合应用、实验基本操作能力及实验方案设计能力,综合性较强,难点是根据实验目的及物质的性质分析各装置的作用,注意要排除其它因素干扰,题目难度中等.


科目:高中化学 来源: 题型:解答题
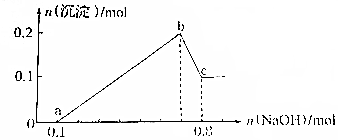 某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示
某溶液中可能含有H+、Mg2+、Al3+、Fe3+、Na+等阳离子中的一种或几种,当向该溶液中加入NaOH溶液时,产生沉淀的物质的量与所加NaOH物质的量之间的关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题:
X、Y、Z、U、W 是原子序数依次增大的前四周期元素.其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子.请回答下列问题: .
.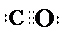 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
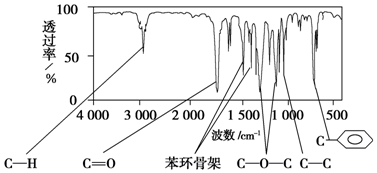
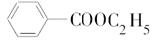 .
.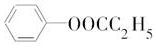 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
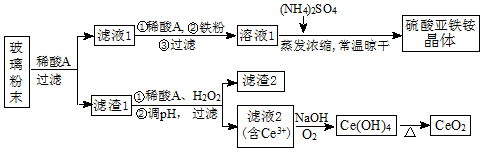
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
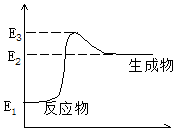 C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )
C(s)+H2O(g)→CO(g)+H2(g)+Q,反应过程中能量(E)的变化如图所示,下列说法正确的是( )| A. | 减小压强时,Q的值增大 | B. | 升高温度时,Q的值减小 | ||
| C. | 该反应是吸热反应 | D. | Q=E3-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2RO3 | B. | H2RO4 | C. | HRO3 | D. | HRO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | 甲 | 乙 | 丙 |
| A | Al2O3 | HNO3 | NaOH |
| B | N2 | O2 | NH3 |
| C | SiO2 | KOH | HF |
| D | SO2 | Ba(OH)2 | NaHCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com