
 CO(g) ��H2(g) ��H=" +131.3" kJ?mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ�ӿ췴Ӧ���������������H2O��ƽ��ת���ʵ��� ��(�����)
CO(g) ��H2(g) ��H=" +131.3" kJ?mol-1�����Ϸ�Ӧ�ﵽƽ������������������£����´�ʩ�ӿ췴Ӧ���������������H2O��ƽ��ת���ʵ��� ��(�����)| A�������¶ȡ� | B������̼������ | C��������� | D����CO���ռ���ȥCO E.����ѹǿ |
 2CO��g�� ��H=+172.5kJ?mol-1
2CO��g�� ��H=+172.5kJ?mol-1 CO2(g)��H2(g)���õ��������ݣ�
CO2(g)��H2(g)���õ��������ݣ�| �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ����x��ʱ��/min | ||
| H2O | CO | H2 | CO | ||
| 900 | 1.0 | 2.0 | 0.4 | 1.6 | 3.0 |
 2NH3(g) ��H��-92.4kJ?mol-1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ��
2NH3(g) ��H��-92.4kJ?mol-1��ʵ����ģ�⻯���������ֱ��ڲ�ͬʵ�������·�Ӧ��N2Ũ����ʱ��仯����ͼ��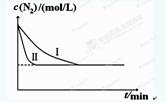

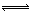 CO2(g)+2H2(g) ?H="90.1" kJ?mol-1��3�֣�
CO2(g)+2H2(g) ?H="90.1" kJ?mol-1��3�֣�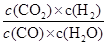 =
=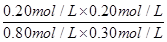 =0.17 ��3�֣�
=0.17 ��3�֣�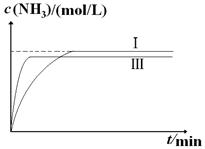 ��2�֣������������Դ���0����Ȣ��1�֣��Ȣ���1�֣�
��2�֣������������Դ���0����Ȣ��1�֣��Ȣ���1�֣� CO2(g)+2H2(g)��Ȼ����ݸ�˹�������ʱ䣬?H=2?H1��?H2="2��131.3" kJ?mol-1��172.5kJ?mol-1="90.1" kJ?mol-1���ɵ��Ȼ�ѧ����ʽ��
CO2(g)+2H2(g)��Ȼ����ݸ�˹�������ʱ䣬?H=2?H1��?H2="2��131.3" kJ?mol-1��172.5kJ?mol-1="90.1" kJ?mol-1���ɵ��Ȼ�ѧ����ʽ�� H2(g) + CO2(g)
H2(g) + CO2(g) 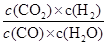 =
=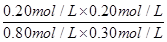 =0.17
=0.17

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ�ʵ����
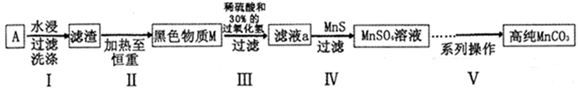
 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6 10-24)
10-24)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
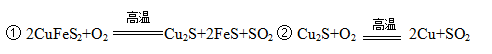

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����NH3ͨ����з�̪��ˮ�У���Һ��죺NH3+ H2O  NH3��H2O NH3��H2O  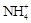 + OH�� + OH�� |
B��ͭ��Ũ���Ṳ�Ȳ������壺Cu��H2SO4(Ũ�� Cu2+ + SO42- �� H2�� Cu2+ + SO42- �� H2�� |
| C��CH3COONa��ˮ��Һ�ʼ��ԣ�CH3COO- + H2O �� CH3COOH + OH- |
| D����NaOH��Һ����Cl2��Cl2��2OH- �� 2Cl- + H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A��MnO2��Ũ���ᷴӦ��Cl2:MnO2+4HCl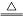 Mn2++2Cl-+Cl2��+2H2O Mn2++2Cl-+Cl2��+2H2O |
B����������ˮ����Al(OH)3����:Al3++3H2O Al(OH)3��+3H+ Al(OH)3��+3H+ |
C��Na2O2����ˮ����O2:Na2O2+H2O 2Na++2OH-+O2�� 2Na++2OH-+O2�� |
D��Ca(HCO3)2��Һ������NaOH��Һ��Ӧ: HC+Ca2++OH- CaCO3��+H2O CaCO3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
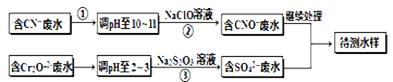
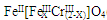 (��������,�������ֱ�ʾԪ�ؼ�̬)�ij���������1mol Cr2O72-�������a mol FeSO4?7H2O�����н�����ȷ���� ��
(��������,�������ֱ�ʾԪ�ؼ�̬)�ij���������1mol Cr2O72-�������a mol FeSO4?7H2O�����н�����ȷ���� ��| A��x ="0.5" ,a =8 | B��x ="0.5" ,a = 10 | C��x =" 1.5" ,a =8 | D��x =" 1.5" ,a = 10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

A��a���߱�ʾ�����ӷ���ʽΪ: +H++H2O +H++H2O Al(OH)3�� Al(OH)3�� |
| B��b��c���߱�ʾ�����ӷ�Ӧ����ͬ�� |
| C��M��ʱ,��Һ�г���������Ϊ3.9 g |
D��ԭ�����Һ�е�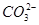 �� �� �����ʵ���֮��Ϊ1��2 �����ʵ���֮��Ϊ1��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
A����ˮʹ��̪��Һ��죺NH4����H2O NH3��H2O��H�� NH3��H2O��H�� |
| B������ʹ̼����ܽ⣺CaCO3��2CH3COOH=Ca2����2CH3COO����CO2����H2O |
| C��������Һʹ���Ը��������Һ��ɫ��2MnO4����5H2C2O4��6H��=2Mn2����10CO2����8H2O |
D������ˮ��Ͷ������������������������Ľ��壺Al3����3H2O Al(OH)3(����)��3H�� Al(OH)3(����)��3H�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����������������ʴ��2Fe��O2��2H2O=2Fe(OH)2 |
| B��SO2ʹ��ɫʯ����Һ���ɫ��SO2��H2O=SO32-��2H�� |
| C������NaOH��Һ��ȥ���������������Ĥ��Al2O3��2OH��=2AlO2-��H2O |
| D��84����Һ�ͽ������ʹ�û�����ж����壺Cl����ClO����2H��=Cl2����H2O |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com