
| A. | 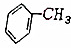 | B. | 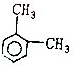 | C. |  | D. | 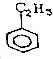 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题

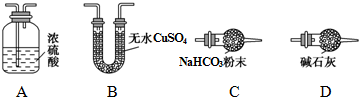
| 乙装置的质量(g) | 丙装置的质量(g) | |
| 加热前 | 80.00 | 62.00 |
| 加热后 | 80.36 | 62.88 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)
.其反应类型为消去反应.检验生成的乙烯要将气体先后通入氢氧化钠溶液、酸性高锰酸钾溶液或溴水中.(填试剂名称)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | C | D | F | |||||
| 三 | B | E | G | R | ||||
| 四 | A | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯用途之一:可作为植物生长调节剂 | |
| B. | CH4与Cl2以体积比1:4混合,光照时可制得纯净的CCl4 | |
| C. | 苯能在一定条件下跟H2加成生成环己烷 | |
| D. | 工业上可用乙烯与水在一定条件下进行加成反应制取酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | P、S、Cl元素最高正化合价依次增小 | |
| C. | N、O、F原子半径依次增大 | |
| D. | Na、K、Rb的电子层数依次增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O很稳定,是因为水分子之间存在氢键 | |
| B. | 由于F非金属性最强,HF的氢键键能最大,所以HF的熔、沸点最高 | |
| C. | 卤素单质从上到下熔沸点升高,是因为它们的组成结构相似,从上到下其摩尔质量增大,分子间的范德华力增大 | |
| D. | 氨气极易溶于水,与氢键没有关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
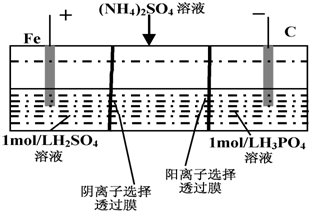
| A. | 阳极室溶液由无色变成棕黄色 | |
| B. | 阴极的电极反应式为:4OH--4e-=2H2O+O2↑ | |
| C. | 电解一段时间后,阴极室溶液中的酸性减弱 | |
| D. | 电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) | |
| C. | Na2CO3溶液:c(Na+)=2c(CO32-)+c(HCO3-) | |
| D. | CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)+c(H+)=c(CH3COO-)+c(OH?)+c(Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com