
【题目】关于卤族元素的下列说法正确的是
A. 所有卤族元素的微粒都易得电子
B. 和氟同一主族的元素都是非金属元素
C. 化合物中卤族元素都显负价
D. 卤族元素原子的原子半径从上到下逐渐减小
科目:高中化学 来源: 题型:
【题目】我们在学习和生活过程中所观察的以下现象与电化腐蚀有关的是
A. 光亮的自行车钢圈不易生锈
B. 炒过菜的铁锅未及时洗净出现红褐色锈斑
C. 光亮的铜丝在火焰上灼烧后变黑
D. 实验室镁带拆封放置一段时间后表面变灰暗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 冰融化时,分子中H—O键发生断裂
B. 随着电子层数的增加,卤化物CX4分子间作用力逐渐增大,所以它们相应的熔沸点也逐渐升高
C. 由于H—O键比H—S键牢固,所以水的熔沸点比H2S高
D. 在由分子所构成的物质中,分子间作用力越大,该物质越稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 多年前,一艘载着天然苏打晶体(Na2CO3·10H2O)的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触的地方出现了许多晶莹发亮的珠子。回答下列问题:
(1)沙滩上沙粒的主要成分为_______(填化学式)。
(2)上述晶莹发亮的珠子可能是______(填字母)。
A. 水晶颗粒 B.无水碳酸钠 C.晶体硅 D.玻璃珠
(3)生成该珠子时发生反应的化学方程式为_____________。
(4)氢氟酸常用作玻璃的蚀刻剂,原因是______________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】居室装修用的石材放射性的监测常用![]() 作为标准,居里夫人因对Ra元素的研究两度获得诺贝尔奖。下列叙述中不正确的是( )
作为标准,居里夫人因对Ra元素的研究两度获得诺贝尔奖。下列叙述中不正确的是( )
A. 一个![]() 原子中含有138个中子
原子中含有138个中子
B. Ra元素位于元素周期表中第七周期第ⅡA族
C. RaCO3难溶于水
D. Ra(OH)2是一种两性氢氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图所示的原电池,下列说法正确的是 ( )
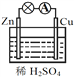
A. Zn片发生还原反应
B. 电子由锌片通过导线流向铜片
C. 该装置能将电能转化为化学能
D. 铜片上发生的反应为Cu - 2e- ![]() Cu2+
Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产中有广泛用。
(1)稀硝酸与二价活泼金属M反应制备硝酸盐,当反应物之比n(HNO3)∶n(M)=5∶2时,还原产物为___(填化学式)。
(2)连二次硝酸(HO-N=N-OH)是一种二元弱酸,向0.1 mol·L-1连二次硝酸钠(Na2N2O2)溶液中滴加酚酞,溶液变红色 ,用离子方程式表示其主要原因:__________________。
(3)已知以下热化学方程式: 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH1
4NO2(g)+O2(g) ΔH1
2NO(g)+O2(g)=2NO2(g) ΔH2
3NO2(g)![]() N2O5(g)+NO(g) ΔH3
N2O5(g)+NO(g) ΔH3
①ΔH3=______________________(用ΔH1、ΔH2表示)。
②一定温度下,在恒容密闭容器中进行反应:3NO2(g)![]() N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________。
N2O5(g)+NO(g),下列表明反应已达到平衡状态的是________。
A.容器内总压强保持不变 B.容器内气体密度保持不变
C.v正(NO2)∶v逆(N2O5)=3∶1 D.![]() 保持不变
保持不变
(4)在密闭容器中充入NO,发生反应2NO(g)![]() N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
N2(g)+O2(g) ΔH,达到平衡之后,升高温度,平衡常数K减小。
①ΔH________0。(填“>”“<”或“=”)
②上述反应达到平衡之后,仅缩小容器体积,下列推断正确的是_________。
A.NO的浓度不再变化
B.NO的转化率不再变化
C.正、逆反应速率不再变化
D.容器内气体压强不再变化
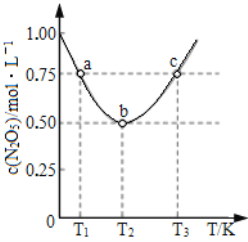
(5)在2 L恒容密闭容器中投入一定量的N2O5(g),发生反应:2N2O5(g)![]() 4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________(填“增大”“减小”或“不变”)。
4NO2(g)+O2(g),测得c(N2O5)与温度关系如图所示。T2 K时,该反应的平衡常数K为_________。若平衡时温度不变,再向容器中充入少量的N2O5气体,达到新平衡时N2O5的转化率会_________(填“增大”“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com