C
分析:A.根据c=
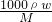
变形计算原NaOH溶液的质量分数;
B.根据钠离子守恒有:n(NaCl)+n(NaClO)=n(NaOH),据此计算n(NaCl);
C.根据Cl
2+2NaOH=NaCl+NaClO+H
2O计算与NaOH反应的氯气为;
D.所得混合物冷却后用NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol,说明氢气与氯气反应中氯气有剩余,溶液为氯化钠和次氯酸钠的混合液,根据钠元素及氯元素守恒可知2n(Cl
2)=n(Na
+)=n(Cl
-)+n(ClO
-);根据电子转移守恒,计算氯气发生氧化还原反应生成的氯离子的物质的量,溶液中Cl
-来源于氯化氢及氯气与氢氧化钠的反应,计算反应后混合气体中氯化氢的物质的量,根据氢元素守恒计算氢气的物质的量.
解答:A.根据c=
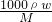
可知,原NaOH溶液的质量分数=
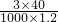
=10%,故A正确;
B.根据钠离子守恒有:n(NaCl)+n(NaClO)=n(NaOH),故n(NaCl)=0.1L×3.00mol/L-0.05mol=0.25mol,故B正确;
C.溶液中含有NaClO的物质的量为0.05mol,根据Cl
2+2NaOH=NaCl+NaClO+H
2O可知,与NaOH反应的氯气为0.05mol,故C错误;
D.测得反应后溶液中含Cl
-、ClO
-,根据电荷守恒可知,溶液中n(Na
+)=n(Cl
-)+n(ClO
-)=0.3mol,所以n(Cl
2)=

×0.3mol=0.15mol,
由于由于溶液中n(ClO
-)=0.05mol,所以溶液中n(Cl
-)=0.3mol-0.05mol=0.25mol;
令氯气与氢氧化钠反应生成的氯离子的物质的量为xmol,根据电子转移守恒有x=0.05mol,
溶液中Cl
-来源于氯化氢及氯气与氢氧化钠的反应,所以氯化氢提供的氯离子为0.25mol-0.05mol=0.2mol,
即反应后的混合气体中n(HCl)=0.2molmol,根据氢元素守恒可知,n(H
2)=

n(HCl)=

×0.2mol=0.1mol,所以所用氯气和参加反应的氢气的物质的量之比为0.15mol:0.1mol=3:2,故D正确;
故选C.
点评:考查氧化还原反应的计算,难度中等,判断溶液中n(Na
+)=n(Cl
-)+n(ClO
-)是解题关键,注意从质量守恒的角度结合反应的有关方程式计算.

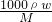 变形计算原NaOH溶液的质量分数;
变形计算原NaOH溶液的质量分数;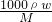 可知,原NaOH溶液的质量分数=
可知,原NaOH溶液的质量分数=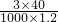 =10%,故A正确;
=10%,故A正确; ×0.3mol=0.15mol,
×0.3mol=0.15mol, n(HCl)=
n(HCl)= ×0.2mol=0.1mol,所以所用氯气和参加反应的氢气的物质的量之比为0.15mol:0.1mol=3:2,故D正确;
×0.2mol=0.1mol,所以所用氯气和参加反应的氢气的物质的量之比为0.15mol:0.1mol=3:2,故D正确;

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案