A��B��C��D�������嶼���е�Ԫ�أ���֪A���ڸ��¸�ѹ����������������B��B��ˮ��Һ��һ�����B�����������Ĵ������õ�C��C��˫ԭ��������ڿ����м��������õ�D��D�����Ṥҵβ�����к�����֮һ������ˮ��Ӧ����C��һԪǿ��E����Ҫ����գ�1��д�����з�Ӧ�Ļ�ѧ����ʽ��
��A��B��
��
��A��C��
��
��C��D��
2NO+O2=2NO2
2NO+O2=2NO2
��
��Dͨ��ˮ�У�
3NO2+H2O=2HNO3+NO
3NO2+H2O=2HNO3+NO
��
��2��д��ǿ��E��ͭƬ��Ӧ�ֱ�����C��D�����ӷ���ʽ��
��
33Cu+2NO3-+8H+=Cu2++2NO��+4H2O
33Cu+2NO3-+8H+=Cu2++2NO��+4H2O
��
��
Cu+2NO3-+4H+=Cu2++2NO2��+2H2O
Cu+2NO3-+4H+=Cu2++2NO2��+2H2O
��
��3��B�ܱ�Cl
2��������A��һ����Σ�д����Ӧ��ѧ����ʽ��
8NH3+3Cl2=N2+6NH4Cl
8NH3+3Cl2=N2+6NH4Cl
��



 ���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
���ɶ���ܲ��¿�ֱͨ�п�ϵ�д�
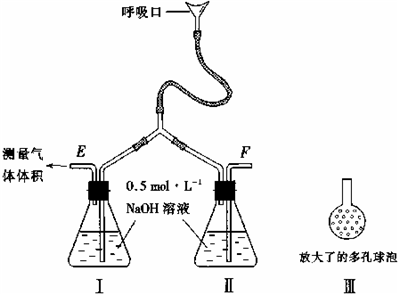


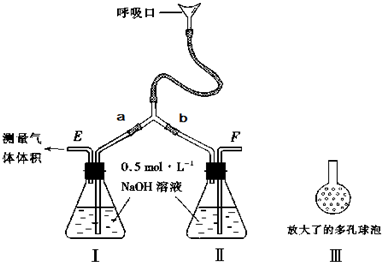
3C(g)+D(g)���ں����´ﵽƽ��״̬���ǡ� (������ )