
【题目】有可逆反应Fe(s)+CO2(g)![]() FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
FeO(s)+CO(g),已知在温度938K时,平衡常数K=1.5,在1173K时,K=2.2。则下列说法不正确的是
A. 该反应的平衡常数表达式为K=c(CO)/c(CO2)
B. 该反应的逆反应是放热反应
C. v正(CO2)=v逆(CO)时该反应达到平衡状态
D. c(CO2):c(CO)=1:1时该反应达到平衡状态
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4)+ c(HC2O4–)+ c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是

A. pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B. c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C. c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D. pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和CO均为燃煤烟气中的主要污染物,对二者的治理备受瞩目。
请回答下列问题:
(1)下列事实中,不能用于比较硫元素和碳元素非金属性强弱的是___________(填选项字母)。
A.SO2能使酸性KMnO4溶液褪色而CO2不能
B.相同条件下,硫酸的酸性强于碳酸
C.CS2中硫元素显-2价
D.相同条件下,SO3的沸点高于CO2
(2)有人设计通过硫循环完成二者的综合处理,原理为
i.2CO(g) +SO2 (g)![]() S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
S(l)+2CO2(g) △H1=-37.0 kJ·mol-1
ii.S(l) + 2H2O(g)![]() 2H2(g) + SO2(g) △H2 =-45.4 kJ·mol-1
2H2(g) + SO2(g) △H2 =-45.4 kJ·mol-1
1 mol CO和水蒸气完全反应生成H2和CO2的热化学方程式为__________________________。
(3)T℃,向5L恒容密闭容器中充入2 mol CO和1 mol SO2,发生反应i。10min达到平衡时,测得S(l)的物质的量为0.8mol。
①010 min内,用CO表示该反应速率v(CO)=____________________。
②反应的平衡常数为______________________。
(4)起始向密闭容器中充入一定量的S(1)和H2O(g),发生反应ii。H2O(g)的平衡转化率与温度(T)和压强(p)的关系如图所示。

①M、P两点的平衡转化率:a(M)___________a(P)(填“>”“<”或“=”),理由为_____________________。
②N、P两点的平衡常数:K(N)___________K(P)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究化学反应有重要的意义。请回答下列问题:
(1)已知在25 ℃,101 kPa下,断开1 mol H—H键要吸收436 kJ的能量,断开1 mol I—I键要吸收151 kJ的能量,断开1 mol I—H键要吸收298 kJ的能量。
①通过以上数据计算当I2和 H2反应生成2 mol H—I时会放出9kJ的能量;若将1 mol I2和1 mol H2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25 ℃,101 kPa)远小于上述计算值,你认为最可能的原因是_______________________。
(2)一定条件下,甲烷与水蒸气发生反应:CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
CO(g) + 3H2(g),工业上可利用此反应生产合成氨原料气H2。
①一定温度下,向2L恒容密闭容器中充入1.6 mol CH4和2.4 mol H2O(g)发生上述反应,CO(g)的物质的量随时间的变化如图所示。0~2 min内的平均反应速率υ(H2)=__________ mol·L-1·min-1, 平衡时CH4的转化率为_____________。[转化率=![]() ×100%]
×100%]

②若要进一步提高该反应的化学反应速率,除了使用催化剂和升高温度外, 还可以采取的措施有_______________________(任写一条)。
③下列能说明上述反应达到平衡状态的是________(填代号)。
a υ逆(CH4)=3υ正(H2)
b 恒温恒容时,容器内混合气体的密度保持不变
c CH4(g)、H2O(g)的浓度保持不变
d CH4(g)、H2O(g)、CO(g)、H2(g)的物质的量之比为1:1:1:3
e 断开3 mol H-H键的同时断开2 mol O-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的NaHCO3和Na2O2的混合物置于一密闭容器中充分加热,反应中转移的电子数为1mol,下列说法一定正确的是( )
A. 混合物中NaHCO3和Na2O2物质的量一定相等
B. 容器中肯定有0.5molO2
C. 反应后,容器中的固体只有Na2CO3
D. 反应后,容器中一定没有H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《本草纲目》记载:“烧酒,其法用浓酒和糟入甑,蒸令气上,用器承滴露,”“凡酸坏之酒,皆可蒸烧”。这里用到的实验方法可以用于分离( )
A.植物油和食盐水B.丁醇和乙醚
C.硝酸钾和氯化钠D.碳酸钙和硫酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】性激素、胃蛋白酶、纤维素和DNA中都含有的元素是( )
A. C、H、O B. C、H、O、N
C. C、H、O、N、P D. C、H、O、N、P、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“分子筛”是一种具有多孔结构的铝硅酸盐(NaAlSiO4·nH2O),其中有许多笼状孔穴和通道,能让直径比孔穴小的分子通过而将大的分子留在外面,故此得名。利用铝灰(主要成分为Al、Al2O3、AlN、FeO等)制备“分子筛”的一种工艺流程如下:
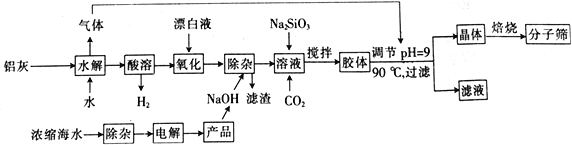
(1)“分子筛”的化学式用氧化物形式可表示为_______________。
(2)铝灰水解产生的气体为________(填化学式);“水解”在加热条件下而不在室温下进行的原因是________________________。
(3)“酸溶”时,发生氧化还原反应的离子方程式为_________________________________。
(4)该工艺中滤渣的颜色为________________________。
(5)某学习小组设计实验模拟从浓缩海水(含Ca2+、Mg2+、SO42-)中提取试剂级NaCl:
![]()
①实验中若向浓缩海水中加入的是Na2CO3浓溶液,则有难溶的Mg2(OH)2CO3生成,同时有气体逸出。该反应的离子方程式为__________________________________。
②该学习小组发现上述实验即使BaCl2用量不足,第Ⅲ步沉淀中依然含有少量BaCO3。从平衡角度分析其原因:_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com