
| 氢氧化物 | Al(OH)3 | Mg(OH)2 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 3.10 | 8.54 | 2.01 | 7.11 |
| 完全沉淀的pH | 4.77 | 11.04 | 3.68 | 9.61 |
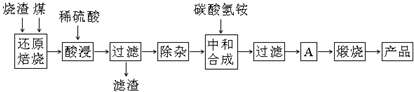
分析 工业废渣主要含Fe2O3及少量SiO2、A12O3、CaO、MgO等杂质,加煤燃烧可生成CO、SO2等有毒气体,加硫酸后只有二氧化硅不反应,酸浸时间过长,溶液中Fe2+含量将下降,被氧化生成Fe3+,过滤除去二氧化硅,然后除杂时结合生成沉淀的pH可知,pH大于4.77,小于7.11时Fe3+和Al3+完全转化为沉淀,而亚铁离子没有转化为沉淀,“中和合成”的目的是将溶液中Fe2+转变为碳酸亚铁沉淀,过滤得到A为碳酸亚铁,需要洗涤、干燥,然后加热得到氧化铁,
(1)加煤燃烧可生成CO、SO2等有毒气体;
(2)亚铁离子被氧化为铁离子,亚铁离子含量降低;
(3)除去Fe3+和Al3+,依据图表中沉淀所需PH分析判断,常温下Ksp[Al(OH)3]=2.0×10-33,则c(Al3+)=$\frac{Ksp[Al(OH)_{3}]}{c(O{H}^{-})^{3}}$,据此计算;
(4)碳酸氢铵与硫酸亚铁发生反应生成二氧化碳气体和碳酸亚铁沉淀;若用等物质的量的碳酸铵替代碳酸氢铵,碳酸根离子过量,水解显碱性,据此分析;
(5)A为碳酸亚铁,需要洗涤、干燥;
(6)制得的红氧化铁中含氧化铁不得少于98.0%,制取的红氧化铁ng中含有的铁的物质的量应该大于:
$\frac{ng×98%}{160g/mol}$×2=$\frac{n×98%}{80}$mol,据此计算质量分数.
解答 解:(1)由上述分析可知,“还原焙烧”中产生的有毒气体可能有CO、SO2等,
故答案为:CO、SO2等;
(2)在空气中酸浸时间过长,溶液中Fe2+含量将下降,其原因是4Fe2++O2+4H+=4Fe3++2H2O;
故答案为:4Fe2++O2+4H+=4Fe3++2H2O;
(3)由生成沉淀的pH可知,pH大于4.77,小于7.11时Fe3+和Al3+完全转化为沉淀,而亚铁离子没有转化为沉淀,则除去Fe3+和Al3+,溶液的pH最大值应小于7.11;已知常温下Ksp[Al(OH)3]=2.0×10-33,当pH=5时,c(OH-)=10-9mol/L,溶液中c(Al3+)=$\frac{Ksp[Al(OH)_{3}]}{c(O{H}^{-})^{3}}$=$\frac{2.0×1{0}^{-33}}{(1{0}^{-9})^{3}}$=2.0×10-6mol/L;
故答案为:7.11;2.0×10-6;
(4)硫酸亚铁溶液与碳酸氢铵溶液混合后发生应生成二氧化碳气体和碳酸亚铁沉淀,发生反应的离子方程式为Fe2++2HCO3-=FeCO3↓+CO2↑+H2O,若用等物质的量的碳酸铵替代碳酸氢铵,碳酸根离子过量,水解显碱性,将溶液中的镁离子、钙离子与亚铁离子一同沉淀,煅烧沉淀所得的产品中混有CaO、MgO杂质;
故答案为:Fe2++2HCO3-=FeCO3↓+CO2↑+H2O;CaO、MgO;
(5)A为碳酸亚铁,需要洗涤、干燥,然后加热得到氧化铁;
故答案为:洗涤、干燥;
(6)制得的红氧化铁中含氧化铁不得少于98.0%,制取的红氧化铁ng中含有的铁的物质的量应该大于:
$\frac{ng×98%}{160g/mol}$×2=$\frac{n×98%}{80}$mol,则所选用的烧渣中铁的质量分数应不低于:$\frac{n×98%×56}{80m}$;
故答案为:$\frac{n×98%×56}{80m}$.
点评 本题考查制备实验方案的设计,为高频考点,把握制备原理及实验流程中的反应、物质的性质等为解答的关键,侧重分析与实验、计算能力的综合考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题

| A. | 两烧杯中铜片表面均无气泡产生 | B. | 甲中化学能转化成了电能 | ||
| C. | 甲中铜片是负极 | D. | 乙中铜片是正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含质子数=A-n | B. | 所含中子数=A-Z | C. | 所含电子数=Z+n | D. | 质量数=A+Z |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | M | R |
| 原子半径/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
| 主要化合价 | +1 | +6-2 | +5-3 | -2 | +3 |
 ;所含化学键类型离子键、共价键.
;所含化学键类型离子键、共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
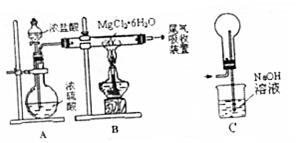
| A. | 装置A制取HCl利用了浓硫酸的吸水性 | |
| B. | 如果直接加热MgCl2•6H2O不能得到MgCl2,将得到Mg(OH)Cl或MgO | |
| C. | 用装置C做为尾气吸收装置,直接与B相连 | |
| D. | 这套装置在设计时未考虑反应结束后滞留在装置中的有害气体的吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
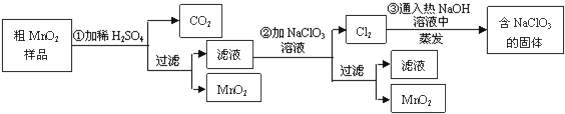
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间 | 开始 | 8h后 | 16h 后 | 24h后 | 32h后 | 40h后 | 48h后 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com