
(9分)某同学对铜与浓硫酸反应产生的黑色沉淀进行探究,实验步骤如下:
Ⅰ.将光亮铜丝插入浓硫酸,加热;
Ⅱ.待产生黑色沉淀和气体时,抽出铜丝,停止加热;
Ⅲ.冷却后,从反应后的混合物中分离出黑色沉淀,洗净、干燥备用。
查阅文献:检验微量Cu2+的方法是:向试液中滴加K4[Fe(CN)6] 溶液,若产生红
褐色沉淀,证明有Cu2+。
(1)该同学假设黑色沉淀是CuO。检验过程如下:
①将CuO放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,产生红褐色沉淀。
②将黑色沉淀放入稀硫酸中,一段时间后,再滴加K4[Fe(CN)6] 溶液,未见红褐色沉淀。由该检验过程所得结论是_______________。
(2)再次假设,黑色沉淀是铜的硫化物。实验如下:
实验装置 | 现象 |
| 1. A试管中黑色沉淀逐渐溶解 2. A试管内上方出现红棕色气体 3. B试管中出现白色沉淀 |
①现象2说明黑色沉淀具有______性。
②能确认黑色沉淀中含有S元素的现象是_________,相应的离子方程式是_____________。
③为确认黑色沉淀是“铜的硫化物”,还需进行的实验操作是___________________。
(3)以上实验说明,黑色沉淀中存在铜的硫化物。进一步实验后证明黑色沉淀是CuS与Cu2S的混合物。将黑色沉淀放入浓硫酸中加热一段时间后,沉淀溶解,其中CuS溶解的化学方程式是_____________。
(9分)(1)黑色沉淀中不含有CuO (1分)
(2)① 还原(1分);② B试管中出现白色沉淀(1分);
2NO3- +3SO2 + 3Ba2+ + 2H2O = 3BaSO4↓+ 2NO↑+ 4H+
(或NO2 + SO2 + Ba2+ + H2O = BaSO4↓+ NO↑+ 2H+)(2分)
③取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物(2分)
(3)CuS + 4H2SO4(浓) CuSO4 + 4SO2↑+ 4H2O (2分)
CuSO4 + 4SO2↑+ 4H2O (2分)
【解析】
试题分析:(1)通过实验证明该黑色固体中不含有CuO;(2)①A试管内上方出现红棕色气体,证明在黑色固体中含有还原性的物质;②A中产生的气体通入B中,在B试管中出现白色沉淀,证明白色沉淀是BaSO4,则黑色固体中含有S元素;相应的离子方程式是2NO3- +3SO2 + 3Ba2+ + 2H2O = 3BaSO4↓+ 2NO↑+ 4H+或NO2 + SO2 + Ba2+ + H2O = BaSO4↓+ NO↑+ 2H+,错误;③ 为确认黑色沉淀是“铜的硫化物”,还应该检验反应后的溶液中还存在Cu2+。故还需进行的实验操作是取冷却后A装置试管中的溶液,滴加K4[Fe(CN)6]溶液,若产生红褐色沉淀,证明有Cu2+,说明黑色沉淀是铜的硫化物;(3)CuS与浓硫酸反应的化学方程式是CuS + 4H2SO4(浓) CuSO4 + 4SO2↑+ 4H2O。
CuSO4 + 4SO2↑+ 4H2O。
考点:考查铜与浓硫酸反应产生的黑色沉淀的元素组成、成分的测定的知识。


科目:高中化学 来源:2014-2015学年上海市虹口区高三上学期期末考试化学试卷(解析版) 题型:填空题
(本题共12分)聚合氯化铝(PAC)的化学式为[Al2(OH)nCl6-n·xH2O]m,它是一种新兴的高效净水剂。
某兴趣小组尝试以工业废弃物铝灰为原料,利用酸溶法制备聚合氯化铝,主要流程如下:

完成下列填空:
40.用37.5%的浓盐酸配置100 mL 6 mol/L盐酸,所需的玻璃仪器有量筒、烧杯、_______。
41.步骤III调节pH至4.0~4.5,其目的是___________________________。为使得到的PAC晶体较纯净,所用的X物质可以是_______(填编号)。
a.氨水 b.铝 c.氢氧化铝 d.偏铝酸钠
42.步骤IV需要保持温度在85℃,可采用的加热方法是_____________。
43.为测定PAC样品中n的值,可以采用如下方法:
①称取一定质量样品,充分研碎后在_________(填仪器名称)中加热、灼烧至质量不再变化,得到1.020g固体,其成分是_________(填化学式)。
②另称取相同质量的样品,用_________(填化学式)溶解后,加入足量AgNO3溶液,得到3.157 g白色沉淀。
由上可知,该PAC样品中n的值为___________。
44.也可用烧碱溶解铝灰,再用稀盐酸调节pH至4.0~4.5,该法称为“碱溶法”。与“酸溶法”相比,“碱溶法”的缺点是______________________________(任写一点)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市长宁区高三上学期教学质量检测化学试卷(解析版) 题型:选择题
用下图装置(夹持、加热装置已略)进行实验,由②中现象,不能证实①中反应发生的是

①中实验 | ②中现象 | |
A | 石蜡油在碎瓷片上受热分解 | Br2的CCl4溶液褪色 |
B | 加热NH4Cl和Ca(OH)2混合物 | 酚酞溶液变红 |
C | NaHCO3固体受热分解 | 澄清石灰水变浑浊 |
D | 铁粉与水蒸气加热 | 肥皂水冒泡 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:填空题
15分)运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义
(1)硫酸生产过程中2SO2(g)+O2(g) 2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如右图所示,根据下图回答下列问题:
2SO3(g),平衡混合体系中SO3 的百分含量和温度的关系如右图所示,根据下图回答下列问题:

①2SO2(g)+O2(g) 2SO3(g)的△H__________0(填“>”或“<”),
2SO3(g)的△H__________0(填“>”或“<”),
②一定条件下,将SO2与O2以体积比2:1置于一体积不变的密闭容器中发生以上反应,能说明该反应已达到平衡的是 。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量百分含量不再变化
d.单位时间内转移4 mol 电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
(2)一定的条件下,合成氨反应为:N2(g)+3H2(g)  2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
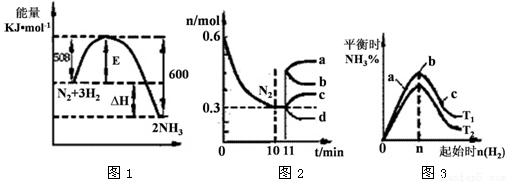
①该反应的平衡常数表达式为 ,升高温度,平衡常数 (填“增大”或“减小”或“不变”)。
②由图2信息,计算0~10min内该反应的平均速率v(H2)= ,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为 (填“a”或“b”或“c”或“d”)
③图3 a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是 点,温度T1 T2(填“>”或“=”或“<”)
(3)若将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,所得溶液中c(H+)-c(OH-)= (填写表达式)(已知:H2SO3:Ka1=1.7×10-2,Ka2=6.0×10-8,NH3·H2O:Kb=1.8×10-5)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省五校高三第一次模拟联考理综化学试卷(解析版) 题型:选择题
对于实验I?IV的描述正确的是

A.实验I :逐滴滴加稀盐酸时,试管中立即产生大量气泡
B.实验II:充分振荡后静置,下层溶液为橙红色,上层无色
C.实验III:从饱和食盐水中提取NaCl晶体
D.装置IV:酸性KMnO4溶液中有气泡出现,且溶液颜色逐渐变浅乃至褪去
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.已知:HI(g)
 H2(g)+
H2(g)+ I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量
I2(s) △H =-26.5kJ/mol,由此可知1mol HI气体在密闭容器中充分分解后可以放出26.5kJ的热量
B.已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-285.8 kJ/mol
C.肼(N2H4)是一种用于火箭或燃料电池的原料,已知
2H2O(g) + O2(g)=2H2O2(l) △H= +108.3kJ/mol ①
N2H4(l) + O2(g)=N2(g) + 2H2O(g) △H=-534.0kJ/mol ②
则有反应:N2H4(l) + 2 H2O2(l) = N2(g) + 4H2O(l) △H=-642.3kJ/mol
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) = CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山西省等四校高三第二次联考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大
D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三1月检测化学试卷(解析版) 题型:选择题
短周期非金属元素原子核外最外层电子数是次外层电子数的一半,该元素
A.在自然界中只以化合态的形式存在
B.单质常用作半导体材料和光导纤维
C.最高价氧化物不与酸反应
D.气态氢化物比甲烷稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com