
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案科目:高中化学 来源: 题型:实验题
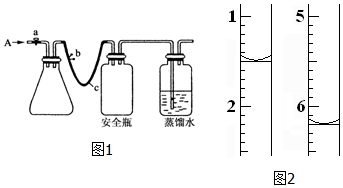
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、NO3-、Fe2+、Na+ | B. | K+、Ba2+、OH-、SO42- | ||
| C. | Ag+、NO3-、Cl-、K+ | D. | Cu2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCN易溶于水 | |
| B. | 氢氰酸溶液可以使pH试纸变红 | |
| C. | NaCN溶液显碱性 | |
| D. | 等物质的量的HCN与NaOH恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO<H2SO3<HClO4 | B. | 稳定性:PH3<H2S<NH3 | ||
| C. | 电负性:P<S<Cl | D. | 沸点:HF<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
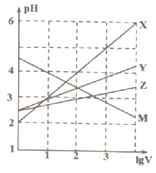 常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3.且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )
常温下取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3.且HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是( )| A. | X是HA,M是HB | |
| B. | 常温下pH:NaA溶液>NaB溶液 | |
| C. | 对于$\frac{c({R}^{-})}{c(HR)c(O{H}^{-})}$的值(R代表A或B),一定存在HA>HB | |
| D. | 若常温下浓度均为0.1mol/L的NaA和HA的混合溶液的pH>7,则c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 AsH3分子的VSEPR模型名称四面体结构,立体构型名称为三角锥,含有的共价键为极性键(极性键,非极性键),属于极性分子(极性分子,非极性分子),砷原子采取sp3杂化.
AsH3分子的VSEPR模型名称四面体结构,立体构型名称为三角锥,含有的共价键为极性键(极性键,非极性键),属于极性分子(极性分子,非极性分子),砷原子采取sp3杂化.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
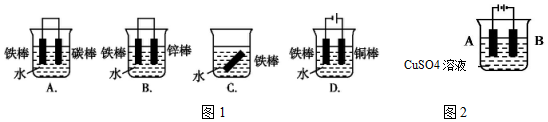
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量比为11:16 | B. | 密度比为11:16 | C. | 体积比为11:16 | D. | 分子个数比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com