
(1)第一次做 的称量;第二次做 的称量;第三次做 的称量;第四次做 的称量。
(2)第一、二次称量的目的是 ,第三、四次称量的目的是 。
(3)从下列仪器中选出实验所需仪器(用字母填写) ,还需要的仪器是 。
A.托盘天平 B.研钵 C.试管夹
D.酒精灯 E.蒸发皿 F.玻璃棒
G.坩埚 H.干燥器 I.石棉网
J.三脚架
(4)下列情况对实验结果造成的误差是偏高、偏低还是不影响?
a.在空气中冷却 ( )
b.坩埚不干燥 ( )
c.坩埚不洁净,附有不分解的污物 ( )
d.硫酸铜晶体含有不分解的杂质 ( )
(5)若坩埚的质量为m
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
(18分)
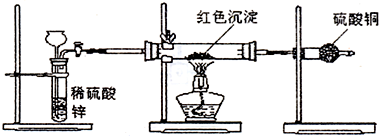
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀 硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾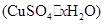 晶体中结晶水的含量时.测得有关数据如下表:
晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
①为完成测定,题29图Ⅲ中还缺少的仪器名称是 。
②判断样品已恒重的方法是 。
③测定所得胆矾![]() 中结晶水含量的实验中,称量操作至少进行 次。
中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与 相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是 。
②判断样品已恒重的方法是 。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源:2010年重庆市高三秋季开学测试化学(理)试题 题型:实验题
(12分)硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.

(1)怎样检查图I装置的气密性 。
(2)图I中分液漏斗内装的液体是 。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
, ,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
|
加热前质量 |
加热后质量 |
|
|
m1(容器) |
m2(容器+晶体) |
m3(容器+无水CuSO4) |
|
5.4g |
7.9g |
6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是 。

②判断样品已恒重的方法是 。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行 次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比) (填“偏高”、“偏低”、“不变”),可能的原因是 。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江西省红色六校高三第二次联考理综化学试卷(解析版) 题型:填空题
硅孔雀石是一种含铜的矿石,含铜形态为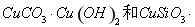
 ,同时含有
,同时含有 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:

请回答下列问题:
(1)完成步骤①中稀硫酸与 发生反应的化学方程式
发生反应的化学方程式
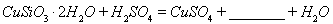 ;
;
用离子方程式表示双氧水的作用_____________________________。
(2)步骤②调节溶液pH选用的最佳试剂是__________________
A. ????????????? ????????????? ? B.CuO????????????? ????????????? ??? C.A12O3????????????? ????????????? ????? D.
????????????? ????????????? ? B.CuO????????????? ????????????? ??? C.A12O3????????????? ????????????? ????? D.
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:

由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下, 饱和溶液中
饱和溶液中 mol
mol ______________。
______________。
(5)若要测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、? “偏低”或“不变”)。???
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com