
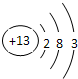
 ,甲是氮化铝,其化学式为:AlN,
,甲是氮化铝,其化学式为:AlN, ,AlN;
,AlN;
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解




查看答案和解析>>
科目:高中化学 来源: 题型:

请完成下列问题:
(1)化合物己的电子式:________________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为______mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为____________。
(4)F的单质与甲反应的离子方程式为_______________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数是次外层的两倍;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30。由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如下图所示:
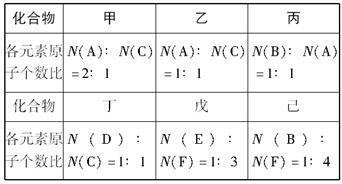
请完成下列问题:
(1)化合物己的电子式:????________________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为______mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为____________。
(4)F的单质与甲反应的离子方程式为_______________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数是次外层的两倍;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30。由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如下图所示:
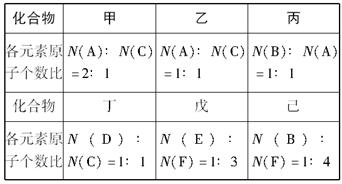
请完成下列问题:
(1)化合物己的电子式:????________________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为______mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为____________。
(4)F的单质与甲反应的离子方程式为_______________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com