
26 12 |
 ;钠在空气中燃烧生成过氧化钠,过氧化钠能和二氧化碳、水反应生成氧气;
;钠在空气中燃烧生成过氧化钠,过氧化钠能和二氧化碳、水反应生成氧气; ;钠在空气中燃烧生成过氧化钠,过氧化钠能和二氧化碳、水反应生成氧气,所以常用于呼吸面具中的供氧剂,发生的反应为:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,
;钠在空气中燃烧生成过氧化钠,过氧化钠能和二氧化碳、水反应生成氧气,所以常用于呼吸面具中的供氧剂,发生的反应为:2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑, ;2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑;
;2Na2O2+2CO2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑;26 12 |


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、约-40℃ |
| B、约-182℃ |
| C、约-108℃ |
| D、约56℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是用于计量微观粒子集体的物理量 |
| B、CO2的摩尔质量为44g |
| C、0.5mol水中约含6.02×1023个H |
| D、标准状况下1 mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠着火时,可用泡沫灭火器灭火 |
| B、蒸发结晶时应将溶液蒸干 |
| C、分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 |
| D、在氢氧化钠溶液中滴入氯化铁饱和溶液可以制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A>B>C>D |
| B、D>B>A>C |
| C、D>C>B>A |
| D、D>B>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ |
| B、氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- |
| C、粗铜精炼时,与电源正极相连的是纯铜,正极反应式为:Cu2++2e-═Cu |
| D、钢铁发生电化学腐蚀的正极反应式:Fe═Fe2++2e- |
查看答案和解析>>
科目:高中化学 来源: 题型:
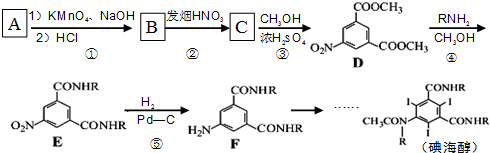
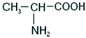 属于α-氨基酸);
属于α-氨基酸);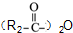 →
→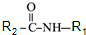 +R2COOH
+R2COOH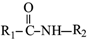 +NaOH→R1COONa+R2NH2
+NaOH→R1COONa+R2NH2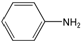 呈弱碱性,易被氧化
呈弱碱性,易被氧化 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体 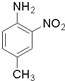 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有机物中一定含有碳和氢两种元素 |
| B、一定条件下,催化剂能提高反应物的转化率 |
| C、将有机物进行“缝合”可以不遵循原子守恒定律 |
| D、将有机物进行“裁剪”需要破坏旧的化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com