
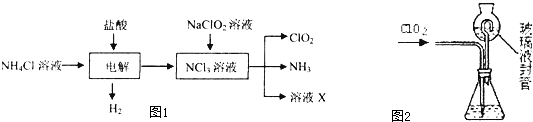
| ||
| ||
| 1 |
| 5 |
| 1 |
| 5 |


科目:高中化学 来源: 题型:
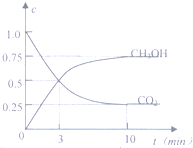 目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);
目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的客闭容器中,充入1molCO2和3molH2,在500℃下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g);查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强度高 | B、不易生锈 |
| C、密度小 | D、导电、导热性好 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO32-、Na+、K+、OH- |
| B、Ba2+、CO32-、NO3-、SO42- |
| C、K+、Cu2+、Cl-、SO42- |
| D、Fe2+、NO3-、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、多糖 | B、蛋白质 | C、脂肪 | D、油脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤ | B、只有①②③ |
| C、只有①②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷的标准燃烧热为-890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |||
| B、500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
C、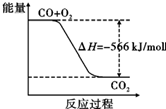 已知:2CO(g)+O2(g)═2CO2(g)△H=-566 kJ/mol,由图可表示由CO生成CO2的反应过程和能量关系 | |||
| D、已知:1mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1mol F-F、S-F键需吸收的能量分别为160 kJ、330 kJ.已知1个 SF6(g)分子中含有6条S-F键.则:S(s)+3F2(g)═SF6(g)△H=-1220 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+H2O═HCl+HClO |
| B、HCl+NaOH═NaCl+H2O |
| C、NaCl+AgNO3═AgCl↓+NaNO3 |
| D、Cu(OH)2+2HCl═CuCl2+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com