
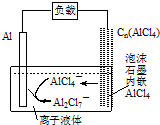
 最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )
最近中美研究人员发明了一种可快速充放电的铝离子电池,该电池电解质为离子液体{AlCl3/[EMIM]Cl},放电时有关离子转化如图所示.下列说法正确的是( )| A. | 放电时,负极发生:2AlCl4--e-=Al2Cl7-+Cl- | |
| B. | 放电时,电路中每流过3mol电子,正极减少27g | |
| C. | 充电时,泡沫石墨极与外电源的负极相连 | |
| D. | 充电时,阴极发生:4Al2Cl7-+3e-=Al+7AlCl4- |
分析 A、放电时,铝是负极失电子;
B、放电时,正极上AlCl4-进入溶液;
C、充电时正极与外接电源的正极相连;
D、充电时,Al2Cl7在阴极得电子发生还原反应.
解答 解:A、放电时,铝是活泼的金属铝是负极,铝发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,故A错误;
B、放电时,正极上AlCl4-进入溶液,负极上Al失电子,则电路中每流过3mol电子,负极减少27g,故B错误;
C、充电时正极与外接电源的正极相连,则泡沫石墨极与外电源的正极相连,故C错误;
D、充电时,Al2Cl7在阴极得电子发生还原反应,即阴极发生:4Al2Cl7-+3e-=Al+7AlCl4-,故D正确;
故选D.
点评 本题考查学生二次电池的工作原理以及原电池和电解池的工作原理知识,属于综合知识的考查,难度中等,注意把握电极的判断方法和电极方程式的书写.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | -CHO的电子式: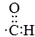 | B. | 乙醇的分子式:CH3CH2OH | ||
| C. | 乙烯的结构简式为:CH2CH2 | D. | 丙烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:6 | B. | 2:15 | C. | 2:11 | D. | 1:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L N2和NH3混合气体中原子间共有3NA个共用电子对 | |
| B. | 3.0 g甲醛HCHO和乙酸混合物中共含碳原子数为0.1NA | |
| C. | 25℃时pH=1的醋酸溶液中含有H+的数目为0.1NA | |
| D. | 标准状况下,2.24 L CH2Cl2含有的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氧化剂是Cl2 | |
| B. | 氧化剂与还原剂的物质的量之比为3:8 | |
| C. | 每生成1molN2,转移3mol电子 | |
| D. | 被氧化与未被氧化的NH3物质的量之比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
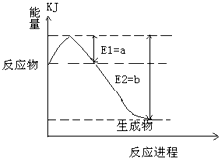 合成氨工业对国民经济和社会发展具有重要意义
合成氨工业对国民经济和社会发展具有重要意义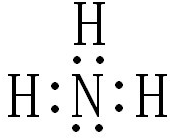
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨在国民经济中占有重要地位,具有广泛的用途.
氨在国民经济中占有重要地位,具有广泛的用途. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
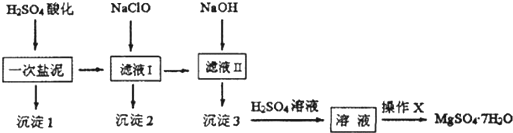
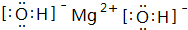 (写电子式).
(写电子式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com