

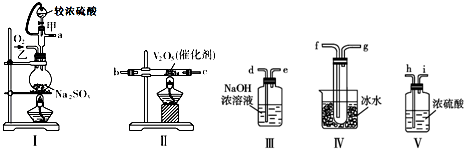
分析 要验证铜与稀硝酸反应生成一氧化氮,则应将装置中的O2排出.当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,但由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深.随着反应的不断进行,E中生成的NO2会被排入C,在C中与水反应生成硝酸,将原来生成的CaCO3沉淀溶解.D装置用来吸收尾气,防止污染环境.
解答 解:(1)当B中的CaCO3与稀硝酸接触时,生成CO2气体.CO2气体可将A中空气排尽,以防止氧化生成的NO,故答案为:产生二氧化碳,排出装置中的空气;
(2)A中产生无色气体为NO,反应的化学方程式为3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,一氧化氮和氧气反应生成红棕色气态二氧化氮,反应的化学方程式为:2NO+O2=NO2,由于CO2的密度大于空气的密度,因此E中采用向下排空气法是不能将空气排尽的.由于E中有残留的少量O2,因此当有NO生成时,E中有少量的NO2生成,从F鼓入空气时,E中生成的NO2增加,红棕色加深,
故答案为:3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,2NO+O2=NO2,二氧化碳密度大于空气,未能排尽烧瓶中的空气,少量NO与空气中的氧气反应生成少量的红棕色的NO2;鼓入空气后,NO与氧气反应,生成大量的红棕色气体二氧化氮;
(3)D装置用来吸收尾气,防止污染环境,
故答案为:吸收尾气,防止污染大气.
点评 本题综合考查物质的性质实验探究,涉及硝酸与铜的反应以及一氧化氮的性质,侧重于学生的分析能力和实验能力的考查,为高考常见题型,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 若a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+)>c(H+)=c(OH-) | |
| B. | 若a1=a2,b1=2b2,则混合溶液中c(CH3COO-)>c(CH3COOH)>c(Na+) | |
| C. | 若a1b1>a2b2,则混合液的pH一定大于7 | |
| D. | a1=a2,且混合溶液的pH<7,则b1一定大于b2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液中HCO3-的数目 | B. | 溶液的pH | ||
| C. | CO32- 水解的平衡常数 | D. | 溶液中的c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3-、Cl-、Fe3+、K+ | B. | Cl-、Ag+、NO3-、Na+ | ||
| C. | SO42-、Al3+、Na+、Cl- | D. | NO3-、HCO3-、Na+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 方案 | 实验操作 | 实验 现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变 成红色 | 白色物 质为 Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白 色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显 现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
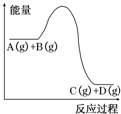
| A. | 加入催化剂时,该反应的反应热发生改变 | |
| B. | 升高温度,利于A的转化率增大 | |
| C. | 该反应的正反应为放热反应 | |
| D. | 增大压强,能够加快反应达到平衡状态的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2完全转化为SO3 | |
| B. | SO2、O2、SO3同时存在 | |
| C. | SO2、O2与SO3的浓度不再随时间变化 | |
| D. | SO2、O2与SO3的物质的量之比为2:1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com